2020-2021學年北京市東城區高三(上)期末化學試卷
發布:2024/11/19 21:0:1
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.下列生活垃圾的處理方法不涉及化學變化的是( )




A.堆肥發酵 B.焚燒發電 C.二次分揀 D.催化降解 A.A B.B C.C D.D 組卷:21引用:1難度:0.8 -
2.下列說法正確的是( )
A.O2和O3互為同位素 B.HCl的電子式為 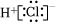
C.CO2的球棍模型為 
D. 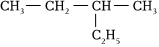 的名稱為2-乙基丁烷組卷:15引用:1難度:0.8
的名稱為2-乙基丁烷組卷:15引用:1難度:0.8 -
3.下列物質的應用與氧化還原反應無關的是( )
A.呼吸面具中用過氧化鈉作供氧劑 B.面團中加入小蘇打,蒸出的饅頭疏松多孔 C.葡萄糖在人體內代謝,可為生命活動提供能量 D.維生素C能促進補鐵劑(有效成分FeSO4)的吸收 組卷:34引用:5難度:0.8 -
4.下列實驗室制取氣體的方法不合理的是( )
A.鋅粒與稀硫酸反應制H2 B.氯化銨受熱分解制NH3 C.電石與飽和食鹽水制C2H2 D.二氧化錳與濃鹽酸共熱制Cl2 組卷:31引用:2難度:0.8 -
5.下列反應的離子方程式書寫正確的是( )
A.用Na2S除去廢水中的Hg2+:S2-+Hg2+═HgS↓ B.用FeCl3溶液刻蝕電路板上的銅:Fe3++Cu═Cu2++Fe2+ C.用過量NaOH溶液脫除煙氣中的SO2:OH-+SO2═HSO3- D.用食醋處理水垢[主要成分CaCO3和Mg(OH)2]:2H++CaCO3═Ca2++CO2↑+H2O 2H++Mg(OH)2═Mg2++2H2O 組卷:29引用:2難度:0.6 -
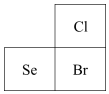 6.已知Cl、Se、Br在元素周期表中的位置如圖所示。下列說法不正確的是( )
6.已知Cl、Se、Br在元素周期表中的位置如圖所示。下列說法不正確的是( )A.原子半徑:Se>Br>Cl B.還原性:Br->Se2->Cl- C.酸性:HClO4>HBrO4>H2SeO4 D.氣態氫化物的穩定性:HCl>HBr>H2Se 組卷:107引用:4難度:0.8
二、解答題(共5小題,滿分58分)
-
18.短程硝化-厭氧氨氧化工藝的目的是將氨氮(
)廢水中的氮元素轉變為N2脫除,其機理如圖1。NH+4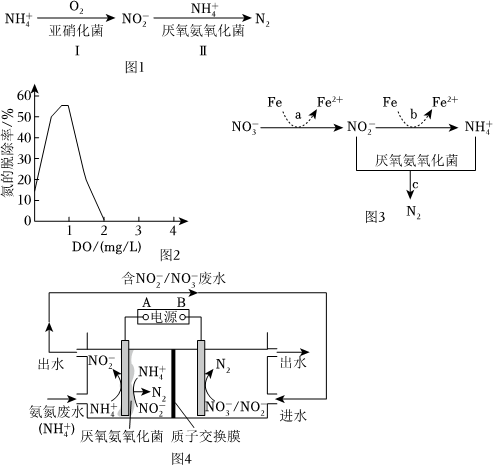
資料:氧氣濃度過高時,會被氧化成NO-2。NO-3
(1)該工藝中被氧化的微粒是。
(2)參與Ⅰ中反應的n():n(O2)=NH+4。
(3)廢水溶解氧濃度(DO)對氮的脫除率的影響如圖2所示。當DO>2mg/L時,氮的脫除率為0,其原因可能是厭氧氨氧化菌被抑制,Ⅱ中反應無法發生;還有可能是。
(4)經上述工藝處理后,排出的水中含有一定量的,可以通過改進工藝提高氮的脫除率。NO-3
①加入還原鐵粉能有效除去。該過程涉及的三個反應(a、b和c)如圖3:在整個反應過程中幾乎監測不到NO-3濃度的增加。請從化學反應速率的角度解釋其原因:NH+4。
②采用微生物電解工藝也可有效除去,其原理如圖4所示。A是電源NO-3極。結合電極反應式解釋該工藝能提高氮的脫除率的原因:。組卷:36引用:2難度:0.6 -
19.某實驗小組對Na2S2O3分別與FeCl3、Fe2(SO4)3的反應進行實驗探究。
實驗藥品:0.1mol/L Na2S2O3溶液(pH=7);0.1mol/L FeCl3溶液(pH=1);0.05mol/L Fe2(SO4)3溶液(pH=1)。
實驗過程
資料:ⅰ.Na2S2O3在酸性條件下不穩定,發生自身氧化還原反應;實驗編號 Ⅰ Ⅱ Ⅲ 實驗操作 


實驗現象 溶液呈紫色,靜置后紫色迅速褪去,久置后出現淡黃色渾濁 溶液呈紫色,靜置后紫色褪去,久置后不出現淡黃色渾濁 溶液呈紫色,靜置后紫色緩慢褪去,久置后不出現淡黃色渾濁
ⅱ.Fe3++S2?Fe(S2O3)+(暗紫色),Fe2+遇S2O2-3無明顯現象O2-3
(1)配制FeCl3溶液時,需要用鹽酸酸化,結合離子方程式解釋原因:。
(2)對實驗Ⅰ中現象產生的原因探究如下:
①證明有Fe2+生成:取實驗Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,觀察到。
②實驗Ⅰ中紫色褪去時S2被氧化成S4O2-3,相關反應的離子方程式是O2-6。
③實驗Ⅰ和Ⅱ對比,Ⅰ中出現淡黃色渾濁,而Ⅱ中不出現淡黃色渾濁的原因是。
(3)為探究實驗Ⅱ和Ⅲ中紫色褪去快慢不同的原因,設計實驗如表:
①試劑X是實驗編號 Ⅳ Ⅴ 實驗操作 

實驗現象 紫色褪去時間a>b 紫色褪去時間c<d 。
②由實驗Ⅳ和實驗Ⅴ得出的結論是。組卷:105引用:3難度:0.5


