2022年北京市東城區(qū)高考化學(xué)一模試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題。本部分共14題,每題3分,共42分。在每題列出的四個(gè)選項(xiàng)中,選出最符合題目要求的一項(xiàng)。
-
1.下列說法正確的是( )
A.電解質(zhì)溶液導(dǎo)電的過程發(fā)生了化學(xué)變化 B.原子核外電子發(fā)生躍遷屬于化學(xué)變化 C.石油分餾利用了石油中各組分化學(xué)性質(zhì)的差異 D.“碳中和”是指利用中和反應(yīng)吸收CO2 組卷:71引用:5難度:0.8 -
2.下列化學(xué)用語或圖示表示不正確的是( )
A.HCl的電子式是 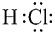
B.N2的結(jié)構(gòu)式是N=N C.乙醇的結(jié)構(gòu)模型是 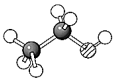
D.Na的原子結(jié)構(gòu)示意圖 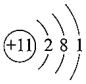 組卷:73引用:2難度:0.7
組卷:73引用:2難度:0.7 -
3.下列分子中的碳原子為sp雜化的是( )
A.CH4 B.HCHO C.C2H2 D.C2H4 組卷:146引用:5難度:0.7 -
4.下列實(shí)驗(yàn)所用主要儀器合理的是( )
A.除去粗鹽中的少量泥沙——分液漏斗 B.實(shí)驗(yàn)室用自來水制取蒸餾水——冷凝管 C.配制一定質(zhì)量分?jǐn)?shù)的NaCl溶液——容量瓶 D.用酸性KMnO4標(biāo)準(zhǔn)溶液滴定草酸溶液——堿式滴定管 組卷:63引用:5難度:0.5 -
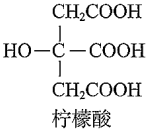 5.檸檬酸是一種食品添加劑,易溶于水,其結(jié)構(gòu)如圖所示。下列關(guān)于檸檬酸的說法不正確的是( )
5.檸檬酸是一種食品添加劑,易溶于水,其結(jié)構(gòu)如圖所示。下列關(guān)于檸檬酸的說法不正確的是( )A.能與H2O形成氫鍵 B.能與NaOH反應(yīng)生成檸檬酸三鈉 C.能在一定條件下發(fā)生消去反應(yīng) D.分子中含有手性碳原子 組卷:131引用:6難度:0.7 -
6.下列方程式與所給事實(shí)不相符的是( )
A.向FeBr2溶液中通入過量Cl2:2Fe2++Cl2═2Fe3++2Cl- B.實(shí)驗(yàn)室制氨氣:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O△C.鋁溶于NaOH溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ D.將充滿NO2的試管倒扣在水中:3NO2+H2O═2HNO3+NO 組卷:128引用:3難度:0.6
二、非選擇題。本部分共5題,共58分。
-
18.CH4在光照條件下與Cl2反應(yīng),可得到各種氯代甲烷。
(1)生成CH3Cl的化學(xué)方程式是。
(2)CH4氯代的機(jī)理為自由基(帶有單電子的原子或原子團(tuán),如Cl?、?CH3)反應(yīng),包括以下幾步:
①寫出由CH3Cl生成CH2Cl2過程中鏈傳遞的方程式:I.鏈引發(fā) Ⅱ.鏈傳遞 Ⅲ.鏈終止 Cl2 =2Cl?光照Cl?+CH4→?CH3+HCl
?CH3+Cl2→CH3Cl+Cl?
…2Cl?→Cl2
Cl?+?CH3→CH3Cl
…,。
②不同鹵原子自由基(X?)均可奪取CH4中的H,反應(yīng)通式:X?(g)+CH4(g)→?CH3(g)+HX(g)△H。
已知:25℃,101kPa時(shí),CH4中C-H和HCl中H-Cl的鍵能分別是439kJ?mol-1和431kJ?mol-1。
a.當(dāng)X為Cl時(shí),△H=kJ?mol-1。
b.若X依次為F、Cl、Br、I,△H隨著原子序數(shù)增大逐漸(填“增大”或“減小”),結(jié)合原子結(jié)構(gòu)解釋原因:。
③探究光照對(duì)CH4與Cl2反應(yīng)的影響,實(shí)驗(yàn)如下。
a.由B和D得出的結(jié)論是編號(hào) 操作 結(jié)果 A 將Cl2與CH4混合后,光照 得到氯代甲烷 B 將Cl2先用光照,然后迅速在黑暗中與CH4混合 得到氯代甲烷 C 將Cl2先用光照,然后在黑暗中放置一段時(shí)間,再與CH4混合 幾乎無氯代甲烷 D 將CH4先用光照,然后迅速在黑暗中與Cl2混合 幾乎無氯代甲烷 。
b.依據(jù)上述機(jī)理,解釋C中幾乎沒有氯代甲烷的原因:。
(3)丙烷氯代反應(yīng)中鏈傳遞的一步反應(yīng)能量變化如圖。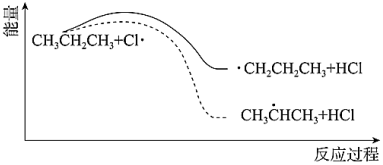
推知-CH3中C-H鍵能比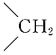 中C-H鍵能 (填“大”或“小”)。組卷:71引用:2難度:0.5
中C-H鍵能 (填“大”或“小”)。組卷:71引用:2難度:0.5 -
19.向KI溶液中持續(xù)通入Cl2,發(fā)現(xiàn)溶液先由無色變?yōu)樽攸S色,一段時(shí)間后褪色。探究溶液變色的原因。
(1)溶液變?yōu)樽攸S色的原因是KI被Cl2氧化為I2,離子方程式是。
【猜測】棕黃色褪去的原因是I2被氧化,氧化產(chǎn)物中I的化合價(jià)記為+x。
【實(shí)驗(yàn)I】設(shè)計(jì)如下實(shí)驗(yàn)驗(yàn)證I2被氧化
(2)①本實(shí)驗(yàn)中,試劑a作裝置 序號(hào) 試劑a 現(xiàn)象 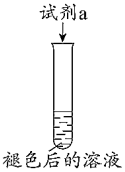
甲 Na2SO3溶液 溶液均變黃,
遇淀粉變藍(lán)乙 KI溶液 劑(填“氧化”或“還原”)。
②甲能證實(shí)I2被氧化而乙不能,原因是。
【實(shí)驗(yàn)Ⅱ】通過如下實(shí)驗(yàn)可測定x
i.取vmLcmol?L-1KI溶液于錐形瓶中,通入過量Cl2至棕黃色褪去。
ii.邊攪拌邊加熱錐形瓶中的溶液,一段時(shí)間后,操作A,試紙不變藍(lán)。
iii.冷卻至室溫后,加入過量KI固體,生成大量紫黑色沉淀(I2)。
iv.立即用amol?L-1Na2S2O3溶液滴定。滴定過程中沉淀逐漸溶解,溶液顏色逐漸變深再變淺。當(dāng)溶液變?yōu)闇\黃色時(shí),加入淀粉溶液,繼續(xù)滴定至終點(diǎn),消耗Na2S2O3溶液bmL。
已知:I2+2S2O32-═S4O62-+2I-
I-+I2?I3-(棕黃色)
I2在純水中溶解度很小,飽和碘水呈淺黃色
(3)ⅱ的目的是除去溶液中的Cl2,操作A是。
(4)結(jié)合數(shù)據(jù),計(jì)算可得x=(用代數(shù)式表示)。
【反思】
(5)實(shí)驗(yàn)過程中,在未知x具體數(shù)值的情況下,iii中為保證所加的KI固體過量,理論上加入的n(KI)應(yīng)大于i中n(KI)的(填數(shù)字)倍。
(6)從平衡移動(dòng)的角度解釋iv中“溶液顏色逐漸變深再變淺”的原因:。組卷:117引用:2難度:0.5


