2020-2021學年遼寧省大連一中高一(下)月考化學試卷(4月份)
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列關于硅單質及其化合物的說法中錯誤的是( )
A.水玻璃可以作為粘合劑、木材防腐劑 B.常溫下,單質硅的性質穩定,與氧氣、氯氣、硝酸、硫酸等很難發生反應 C.SiO2有導電性,所以SiO2可用于制備光導纖維 D.青花瓷胎體的原料為高嶺土[Al2Si2O5(OH)4],若以氧化物形式可表示為:Al2O3?2SiO2?2H2O 組卷:81引用:2難度:0.6 -
2.生活中常用到一些化學知識,下列有關分析中正確的是( )
A.醫療上可用硫酸鋇作X射線透視腸胃的內服藥,是因為硫酸鋇不溶于水 B.氯氣可用作消毒劑和漂白劑,是因為氯氣具有強氧化性,將有機色素氧化為無色物質 C.雨水樣品放置一段時間后pH由4.68變為4.28,是因為水中溶解的CO2增多 D.SO2漂白紙漿和SO2使品紅溶液褪色的原理相同 組卷:34引用:1難度:0.7 -
3.下列關于實驗事故或藥品的處理方法中,正確的是( )
A.氫氧化鈉溶液和硝酸溶液都可以盛裝在帶玻璃塞的無色試劑瓶中 B.大量氯氣泄漏時,用飽和NaOH溶液浸濕毛巾捂住嘴和鼻,并迅速離開現場 C.硫酸亞鐵溶液存放在加有少量鐵粉的試劑瓶中 D.少量的金屬鈉保存在煤油中且金屬鈉著火時,可立即用沾水的毛巾覆蓋 組卷:33引用:2難度:0.8 -
4.化學與人類生活、生產和社會可持續發展密切相關,下列有關說法錯誤的是( )
A.向燃煤中加入CaO可以避免酸雨的形成及溫室氣體的排放 B.華為自主研發的5G芯片的主要原料是Si C.疫情期間用到的“84消毒液”的有效成分為NaClO D.木材和織物用水玻璃浸泡后,不易著火 組卷:18引用:2難度:0.6 -
5.下列依據相關實驗得出的結論正確的是( )
A.向某溶液中加入稀鹽酸,產生的氣體通入澄清石灰水,石灰水變渾濁,該溶液一定是碳酸鹽溶液 B.向溶液中滴加KSCN溶液,溶液不變色,滴加氯水后溶液顯紅色,該溶液中一定有Fe2+ C.將某氣體通入品紅溶液中,顏色褪去,該氣體一定是SO2 D.用鉑絲蘸取某溶液進行焰色反應,火焰呈黃色,該溶液一定是鈉鹽溶液 組卷:22引用:1難度:0.7 -
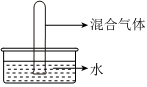 6.在同溫同壓下,將充有等體積混合而成的四組氣體:①NO2+O2;②NO2+NO;③HCl+N2;④SO2+O2,分別通入體積相同的試管,并立即倒立于水槽中,如圖所示,待試管內液面穩定后,剩余氣體體積依次V1、V2、V3、V4,則剩余氣體體積最多的是( )
6.在同溫同壓下,將充有等體積混合而成的四組氣體:①NO2+O2;②NO2+NO;③HCl+N2;④SO2+O2,分別通入體積相同的試管,并立即倒立于水槽中,如圖所示,待試管內液面穩定后,剩余氣體體積依次V1、V2、V3、V4,則剩余氣體體積最多的是( )A.V1 B.V2 C.V3 D.V4 組卷:278引用:7難度:0.7 -
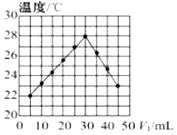 7.將V1mL1.0mol?L-1NaOH 溶液和V2 mL未知濃度的HCl溶液混合均勻后測量并記錄溶液溫度,實驗結果如圖所示(實驗中始終保持V1+V2=50mL)。下列敘述正確的是( )
7.將V1mL1.0mol?L-1NaOH 溶液和V2 mL未知濃度的HCl溶液混合均勻后測量并記錄溶液溫度,實驗結果如圖所示(實驗中始終保持V1+V2=50mL)。下列敘述正確的是( )A.做該實驗時環境溫度為22℃ B.該實驗表明熱能可以轉化為化學能 C.HCl溶液的濃度約是1.5mol?L-1 D.該實驗表明有水生成的反應都是放熱反應 組卷:20引用:1難度:0.7 -
8.根據如圖所示的N2(g)和O2(g)反應生成NO(g)過程中的能量變化情況判斷,下列說法正確的是( )

A.N2(g)和O2(g)反應生成NO(g)是放熱反應 B.2molO原子結合生成O2(g)時需要吸收498kJ能量 C.1molNO(g)分子中的化學鍵斷裂時需要吸收632kJ能量 D.2molN(g)和2molO(g)的總能量為1444kJ 組卷:58引用:5難度:0.6
三、本題共4道大題,共50分
-
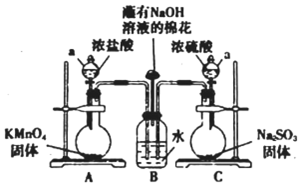 24.某實驗小組欲探究SO2和Cl2能否發生反應,設計如圖所示的實驗裝置進行實驗。
24.某實驗小組欲探究SO2和Cl2能否發生反應,設計如圖所示的實驗裝置進行實驗。
(1)圖中儀器a的名稱為。
(2)裝置A中的反應為2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O,反應中的氧化劑是,生成71g Cl2轉移的電子是mol。
(3)裝置B中蘸有NaOH溶液的棉花的作用是。
(4)打開A、C裝置a的活塞,一段時間后關閉活塞。待反應完全后。小組同學又繼續做如下實驗。
①甲同學取適量B中溶液于試管中,向其中滴加少量AgNO3溶液,有白色沉淀生成。甲同學由此認為SO2和Cl2,發生了反應,理由是該反應中生成了(填離子符號)。
②乙同學認為甲同學的結論不合理,認為A中生成的Cl2中混有雜質,應該在裝置A、B間增加一個洗氣瓶,然后再按甲同學的方法即可得到正確結論,乙同學認為Cl2中混有的雜質是,洗氣瓶中盛有試劑的名稱是。
③丙同學認為甲、乙兩位同學的結論均不合理。丙同學取適量B中溶液于試管中,向其中滴加少量溶液X,有白色沉淀生成,得出結論即SO2與Cl2同時通入水中,可以發生反應。溶液X(填選項序號)。
a.BaCl2溶液
b.Ba(OH)2溶液
c.Ba(NO3)2溶液組卷:23引用:2難度:0.6 -
25.晶體硅是一種重要的非金屬材料,制備純硅的主要步驟如下:
①高溫下用碳還原二氧化硅制得粗硅
②粗硅與干燥HCl氣體反應制得SiHCl3:Si+3HClSiHCl3+H2高溫
③SiHCl3與過量H2在1000℃~1100℃反應制得純硅
已知SiHCl3能與H2O強烈反應,在空氣中易自燃.請回答下列問題:
(1)第①步制備粗硅的化學反應方程式為.
(2)粗硅與HCl反應完全后,經冷凝得到的SiHCl3(沸點33.0℃)中含有少量SiCl4(沸點57.6℃)和HCl(沸點-84.7℃),提純SiHCl3采用的方法為.
(3)用SiHCl3與過量H2反應制備純硅的裝置如下(熱源及夾持裝置略去):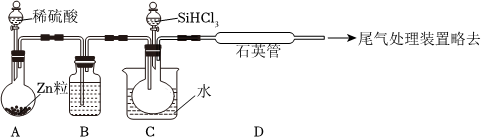
①裝置B中的試劑是.裝置C中的燒瓶需要水浴加熱,其目的是.
②反應一段時間后,裝置D中觀察到的現象是,裝置D不能采用普通玻璃管的原因是,裝置D中發生反應的化學方程式為.
③為保證制備純硅實驗的成功,操作的關鍵是檢查實驗裝置的氣密性,控制好反應溫度以及.
④為鑒定產品硅中是否含微量鐵單質,將試樣用稀鹽酸溶解,取上層清液后需再加入的試劑(填寫字母代號)是.
a.碘水 b.氯水 c.aOH溶液 d.KSCN溶液 e.Na2SO3溶液.組卷:69引用:17難度:0.5


