2023年江蘇省揚州市邗江區梅嶺中學教育集團中考化學二模試卷
發布:2024/6/13 8:0:9
一、單項選擇題:本題包括20小題,每小題2分,共計40分。每小題只有一個選項符合題意。
-
1.證據推理是化學學科的重要素養之一。下列宏觀事實與相關解釋或結論不一致的是( )
A.50mL水和50mL酒精混合后的總體積小于100mL,是由于分子間存在間隙 B.夏日雨后初晴,路面的水漬很快消失,主要是由于水分子運動到空氣中去了 C.水通電分解成氫氣和氧氣,說明水中含有氫、氧兩種元素 D.將CO2通入紫色石蕊試液,試液變紅,說明CO2是一種酸 組卷:251引用:7難度:0.6 -
2.下列變化中屬于化學變化的是( )
A.玻璃破碎 B.動物呼吸 C.水結成冰 D.酒精揮發 組卷:60引用:3難度:0.8 -
3.下列物質由分子構成的是( )
A.鋁 B.干冰 C.氯化鈉 D.金剛石 組卷:58引用:8難度:0.7 -
4.邏輯推理是學習化學常用的思維方法。下列推理正確的是( )
A.原子不顯電性,則不顯電性的微粒一定是原子 B.酸的溶液pH小于7,則pH小于7的溶液一定是酸的溶液 C.有機物一定含有碳元素,則含有碳元素的化合物一定是有機物 D.某物質在氧氣中燃燒生成二氧化碳和水,則該物質一定含有碳元素和氫元素 組卷:23引用:3難度:0.5 -
5.自然界里多數物質含有氧元素。下列屬于氧化物的是( )
A.氧氣 B.過氧化氫 C.氫氧化鎂 D.硫酸鈉 組卷:20引用:2難度:0.8 -
6.下列關于燃料與燃燒的說法不正確的是( )
A.物質與氧氣發生的反應都屬于氧化反應 B.木柴架空燃燒更旺是因為增大了木柴與氧氣的接觸面積 C.“煙頭”能引發火災是因為煙頭改變了可燃物的著火點 D.鎂條可以在氮氣中燃燒,說明燃燒不一定有氧氣參加 組卷:174引用:11難度:0.6 -
7.下列有關化學用語正確的是( )
A.1個鐵離子:Fe2+ B.2個氯氣分子:2Cl C.氧原子的結構示意圖: 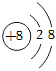
D.葡萄糖的化學式:C6H12O6 組卷:29引用:3難度:0.6 -
8.化學與生活、生產密切相關。下列化學知識的應用或解釋正確的是( )
A.海水“曬鹽”的過程利用的是蒸發結晶 B.在空氣中鋁制品比鐵制品更耐腐蝕,因為鋁的金屬活動性比鐵強 C.關閉燃氣閥門熄滅燃氣灶火焰,利用了隔絕氧氣滅火 D.氧氣能用于鋼鐵冶煉和金屬焊接,利用了氧氣的可燃性 組卷:57引用:4難度:0.6
二、非選擇題
-
24.我國已探明的頁巖氣儲量31.6萬億立方米,儲量世界第一。頁巖氣中含有CH4、CO2、H2S等氣體,是蘊藏于頁巖層可供開采的天然氣資源。頁巖氣的有效利用需要處理其中所含的CO2和H2S。
Ⅰ.CO2的處理:
(1)CO2和CH4一定條件下重整可制合成氣(主要成分為CO、H2),請寫出其發生反應的化學方程式:。
(2)Ni催化CO2加H2形成CH4,其歷程如圖1所示(吸附在催化劑表面的物種用*標注),反應相同時間,含碳產物中CH4的百分含量及CO2轉化率隨溫度的變化如圖2所示。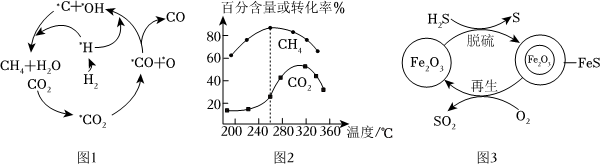
①結合圖2,260℃時生成主要產物所發生反應的化學方程式為。
②溫度高于320℃,CO2的轉化率下降的原因是。
Ⅱ.H2S的處理:Fe2O3可用作脫除H2S氣體的脫硫劑。Fe2O3脫硫和Fe2O3再生反應如圖3。
(3)Fe2O3脫硫劑的脫硫和再生過程可以描述為。
(4)400℃條件下,氧氣濃度較大時,氧氣會將部分FeS氧化成Fe2(SO4)3或FeSO4,出現脫硫劑再生時質量(填“增大”或“減小”),且所得再生脫硫劑脫硫效果差,因此脫硫劑再生時需控制。
(5)脫硫劑再生時可以用水汽代替O2。700℃條件下用水汽代替O2再生時,生成Fe3O4、H2S和H2,Fe3O4也可作脫硫劑寫出水汽作用條件下脫硫劑再生反應的化學方程式:。組卷:73引用:2難度:0.4 -
25.硼酸(H3BO3)能溶于水,可用于玻璃、醫藥、紡織等工業。碳酸鎂可用于制造防火涂料、牙膏等。某工廠以硼鎂鐵礦(主要成分為Mg2B2O5?H2O,雜質有SiO2、FeO、Fe2O3、Al2O3)為原料制備硼酸、碳酸鎂的工藝流程如如圖所示:
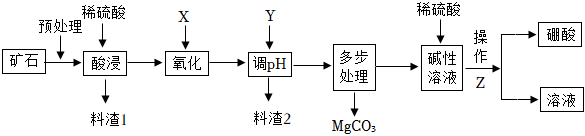
已知:①常溫時實驗條件下幾種金屬離子形成沉淀的pH如下表;
②SiO2不溶于水,也不與酸反應;
③硼酸各溫度下的的溶解度如下表。
硼酸的溶解度
(1)預處理的內容包括礦石的篩選、溫度/℃ 溶解度,g/100g 溫度,℃ 溶解度,g/100g 0 2.77 40 8.90 10 3.65 50 11.39 20 4.87 60 14.89 25 5.74 80 23.54 30 6.77 100 38.00 開始沉淀 完全沉淀 Fe3+ 2.7 3.2 Fe2+ 7.6 9.6 Al3+ 4.0 5.2 Mg2+ 9.6 11.1 ,寫出料渣1的化學式。
(2)酸浸時Mg2B2O5?H2O與硫酸反應生成硫酸鎂和硼酸,寫出化學方程式;氧化過程的化學方程式為:X+H2SO4+2FeSO4=Fe2(SO4)3+2H2O。X化學式是,X作氧化劑的優點。
(3)為提高產品純度,控制的pH范圍是;試劑Y為(填選項)。
A.MgO
B.Fe2O3
C.Fe(OH)3
D.Mg(OH)2
(4)為測量所得硼酸純度,取3.00g制取的硼酸樣品溶于甘露醇與蒸餾水混合溶液中配成500mL溶液,取出25.00mL放入錐形瓶并滴加3滴酚酞試液,用0.004g/mLNaOH標準溶液進行中和滴定,滴定終點時消耗22.00mL標準溶液。則滴定終點時的現象是,樣品中硼酸的純度是?(請寫出計算過程,小數點后保留一位有效數字,中和反應的化學方程式為H3BO3+NaOH═NaH2BO3+H2O)。
(5)操作Z包括:、、過濾、洗滌、干燥。
(6)此工藝流程中提高硼酸產率措施有:、……組卷:58引用:2難度:0.5


