2021-2022學年山東省濰坊四中高一(上)第一次段考化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共10小題,每小題2分,共20分。每小題只有一個選項符合題意)
-
1.關(guān)于化學及人類社會發(fā)展歷程的說法中,錯誤的是( )
A.英國科學家道爾頓提出了原子學說,為近代化學的發(fā)展奠定了基礎 B.我國科學家屠呦呦因發(fā)現(xiàn)青蒿素而獲得2015年諾貝爾生理學或醫(yī)學獎 C.人們可以利用先進的技術(shù)和設備通過化學變化制造出新的原子和新的分子 D.道爾頓的“原子論”和阿伏加德羅的“分子學說”對化學的發(fā)展起到了極大推動作用 組卷:7引用:1難度:0.9 -
2.下列關(guān)于鈉及其化合物的敘述正確的是( )
①Na2O與Na2O2都能和水反應生成堿,它們都是化合反應
②Na2O與Na2O2的陰陽離子個數(shù)比都是1:2
③鈉在常溫下不容易被氧化
④Na2O2可做供氧劑,而Na2O不能
⑤向酚酞溶液中加入Na2O2粉末,溶液先變紅后褪色,并有氣泡生成A.只有④ B.②④⑤ C.②⑤ D.④⑤ 組卷:116引用:4難度:0.7 -
3.某同學想利用所學的知識去探究SO2的性質(zhì),設計了如下研究程序,合理的是( )
A.分類(預測SO2的化學性質(zhì))→觀察(得出SO2的物理性質(zhì))→實驗→比較并得出結(jié)論 B.觀察(得出SO2的物理性質(zhì))→分類(預測SO2的化學性質(zhì))→實驗( 觀察實驗現(xiàn)象、驗證預測)→比較并得出結(jié)論,對于異常現(xiàn)象再預測,再實驗,再驗證 C.觀察(得出 SO2 的物理性質(zhì))→實驗→分類(預測SO2 的化學性質(zhì))→比較并得出結(jié)論 D.實驗→分類(預測SO2的化學性質(zhì))→觀察(得出SO2的物理性質(zhì))→比較并得出結(jié)論 組卷:8引用:2難度:0.6 -
4.下列敘述錯誤的個數(shù)是( )
①摩爾是國際單位制中七個基本物理量之一
②濃度為1mol?L-1的NaCl溶液的含義是1L水中含有1mol NaCl
③6.02×1023就是阿伏加德羅常數(shù)
④1mol水分子中含有2mol氫分子和1mol氧原子
⑤H2O的摩爾質(zhì)量為18gA.2 B.3 C.4 D.5 組卷:95引用:4難度:0.6 -
5.下列有關(guān)實驗操作正確的是( )
A. 
B. 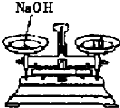
C. 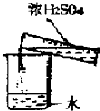
D. 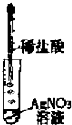 組卷:1引用:3難度:0.7
組卷:1引用:3難度:0.7 -
6.下列敘述中正確的是( )
①標準狀況下,1LCl2和 1L H2O的質(zhì)量之比 71:18;
②25℃、1.01×105Pa 時,1g H2 和 14gN2的體積相同;
③28gCO的體積為22.4L;
④兩種物質(zhì)的物質(zhì)的量相同,則它們在標準狀況下的體積也相同;
⑤在同溫同體積時,氣體的物質(zhì)的量越大,則壓強越大。A.①③④ B.②⑤ C.①⑤ D.⑤ 組卷:12引用:1難度:0.5
二、非選擇題共60分)
-
18.過氧化鈉常作漂白劑、殺菌劑、消毒劑.過氧化鈉保存不當容易吸收空氣中CO2而變質(zhì).
(1)某課外活動小組欲探究某過氧化鈉樣品是否已經(jīng)變質(zhì),取少量樣品,溶解,加入溶液,充分振蕩后有白色沉淀,證明Na2O2已經(jīng)變質(zhì).
(2)該課外活動小組為了粗略測定過氧化鈉的純度,他們稱取a g樣品,并設計用如圖裝置來測定過氧化鈉的質(zhì)量分數(shù).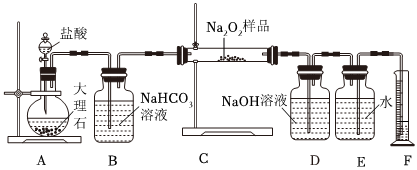
①A中發(fā)生反應離子方程式為.
②將儀器連接好以后,必須進行的第一步操作是.
③B裝置出來的氣體是否需要干燥.(填“是”或“否”)
④寫出裝置C中發(fā)生的所有反應的化學方程式,.
⑤D中NaOH溶液的作用.
⑥實驗結(jié)束時,讀取實驗中生成氣體的體積時,不合理的是.
a.直接讀取氣體體積,不需冷卻到室溫
b.上下移動量筒,使得E、F中液面高度相同
c.視線與凹液面的最低點相平讀取量筒中水的體積
⑦讀出量筒內(nèi)水的體積后,折算成標準狀況下氧氣的體積為V mL,則樣品中過氧化鈉的質(zhì)量分數(shù)為.
⑧實驗完成后E到F之間導管內(nèi)殘留水的體積會使測量結(jié)果.(填“偏大”、“偏小”或“不影響”)組卷:41引用:5難度:0.3 -
19.實驗室需要0.2mol?L-1NaOH 溶液 480mL 和 0.5mol?L-1硫酸溶液500mL。根據(jù)這兩種溶液的配制情況回答下列問題。
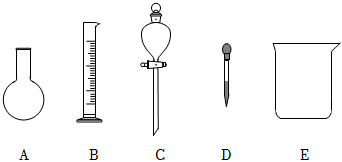
(1)如圖所示的儀器中配制溶液肯定不需要的是(填序號),配制上述溶液還需用到的玻璃儀器是、(填儀器名稱)。
(2)在配制NaOH溶液時:根據(jù)計算用托盤天平稱取NaOH的質(zhì)量為。
(3)在配制硫酸溶液時:所需質(zhì)量分數(shù)為98%、密度為 1.84g?cm-3的濃硫酸的體積為mL(計算結(jié)果保留一位小數(shù));
(4)配制溶液時下列說法正確的是(填字母)。
A.稱量氫氧化鈉時,托盤天平兩盤應用等質(zhì)量的紙片
B.容量瓶用蒸餾水洗凈后,應烘干后才能用于溶液配制
C.量取的濃硫酸應沿玻璃棒慢慢倒入燒杯中,再加水稀釋
D.若將7.8gNa2O2溶于水,配成1L溶液,也可得到濃度為0.2mol?L-1的NaOH溶液
(5)在配制過程中,其他操作都正確,下列操作使所配溶液濃度偏高的是(填序號)。
①洗滌量取濃硫酸的量筒,并將洗滌液轉(zhuǎn)移到容量瓶中
②稀釋后的硫酸溶液未等冷卻至室溫就轉(zhuǎn)移到容量瓶中
③轉(zhuǎn)移前,容量瓶中含有少量蒸餾水
④定容搖勻后,發(fā)現(xiàn)液面低于刻度線,又用膠頭滴管加蒸餾水至刻度線組卷:5引用:1難度:0.6


