人教版(2019)選擇性必修1《第2單元 化學反應速率與化學平衡》2020年單元測試卷(B卷)
發(fā)布:2024/10/27 23:30:1
-
1.下列說法正確的是( )
A.△H<0、△S>0的反應在溫度低時不能自發(fā)進行 B.在其他外界條件不變的情況下,使用催化劑可改變化學反應進行的方向 C.因為焓變和熵變都與反應的自發(fā)性有關(guān),因此焓變或熵變均可以單獨作為反應自發(fā)性的判據(jù) D.NH4HCO3(s)═NH3 (g)+H2O(g)+CO2 (g)△H=+185.57 kJ/mol可能自發(fā)進行,原因是體系有自發(fā)地向混亂度增加的方向轉(zhuǎn)變的傾向 組卷:76引用:3難度:0.5 -
2.下列事實不能用勒夏特列原理解釋的是( )
A.新制的氯水放置一段時間,溶液的pH會減小 B.在配制硫酸亞鐵溶液時往往要加入少量鐵粉 C.恒容容器中反應CO(g)+NO2(g)?CO2(g)+NO(g)ΔH<0達到平衡后,升高溫度,氣體顏色變深 D.增大壓強,有利于SO2與O2反應生成SO3 組卷:147引用:12難度:0.5 -
3.如圖是可逆反應A+2B?2C+3D的化學反應速率與化學平衡隨外界條件改變(先降溫后加壓)而變化的情況,由此可推斷 ( )

A.正反應是吸熱反應 B.若A、B是氣體,則D是液體或固體 C.逆反應是放熱反應 D.A、B、C、D均為氣體 組卷:322引用:29難度:0.9 -
 4.如圖表示某可逆反應在其他條件相同時使用和未使用催化劑,反應過程和能量的對應關(guān)系.下列說法一定正確的是( )
4.如圖表示某可逆反應在其他條件相同時使用和未使用催化劑,反應過程和能量的對應關(guān)系.下列說法一定正確的是( )A.該反應為吸熱反應 B.a(chǎn)與b相比,a的反應速率更快 C.a(chǎn)與b相比,反應的平衡常數(shù)一定不同 D.反應物的總能量大于生成物的總能量 組卷:92引用:6難度:0.7 -
5.加熱N2O5依次發(fā)生的分解反應為:①N2O5?N2O3+O2,②N2O3?N2O+O2;在2L密閉容器中充入8mol N2O5,加熱到t℃,達到平衡狀態(tài)后O2為9mol,N2O3為3.4mol,則t℃時反應①的平衡常數(shù)為( )
A.10.7 mol/L B.8.5 mol/L C.9.6 mol/L D.10.2 mol/L 組卷:77引用:4難度:0.7 -
6.在不同溫度下,向VL密閉容器中加入0.5mol NO和0.5mol活性炭,發(fā)生反應:2NO(g)+C(s)=N2(g)+CO2(g)△H=-Qkj?mol-1(Q>0),達到平衡時的數(shù)據(jù)如下:
下列有關(guān)說法正確的是( )溫度/℃ n (C)/mol n(CO2)/mol T1 0.15 T2 0.375 A.由上述信息可推知:T1>T2 B.T2℃時,若反應達平衡后再縮小容器的體積,c(N2):c(NO)增大 C.T1℃時,若開始時反應物的用量均減小一半,平衡后NO的轉(zhuǎn)化率增大 D.T1℃時,該反應的平衡常數(shù) K=916組卷:76引用:10難度:0.9 -
 7.向絕熱恒容密閉容器中通入SO2和NO2,反應SO2(g)+NO2(g)?SO3(g)+NO(g)在一定條件下達到平衡,反應速率隨時間變化如圖所示。由圖得出的結(jié)論正確的是( )
7.向絕熱恒容密閉容器中通入SO2和NO2,反應SO2(g)+NO2(g)?SO3(g)+NO(g)在一定條件下達到平衡,反應速率隨時間變化如圖所示。由圖得出的結(jié)論正確的是( )A.反應在c點達到平衡狀態(tài) B.反應物的總能量低于生成物的總能量 C.反應物濃度:a點小于b點 D.△t1=△t2時,SO3的產(chǎn)量:a~b段小于b~c段 組卷:113引用:8難度:0.6
-
 21.以煤為原料,經(jīng)過化學加工使煤轉(zhuǎn)化為氣體、液體、固體燃料以及各種化工產(chǎn)品的工業(yè)叫煤化工。
21.以煤為原料,經(jīng)過化學加工使煤轉(zhuǎn)化為氣體、液體、固體燃料以及各種化工產(chǎn)品的工業(yè)叫煤化工。
(1)將水蒸氣通過紅熱的炭即可產(chǎn)生水煤氣。反應為C(s)+H2O(g)?CO(g)+H2(g)ΔH=+131.3kJ?mol-1。
①該反應在常溫下(填“能”或“不能”)自發(fā)進行
②一定溫度下,在一個容積可變的密閉容器中,發(fā)生上述反應,下列能判斷該反應達到化學平衡狀態(tài)的是。(填序號)
a.容器中的壓強不變
b.1mol H-H鍵斷裂的同時,斷裂2mol H-O鍵
c.c(CO)=c(H2)
d.密閉容器的容積不再改變
(2)將不同量的CO(g)和H2O(g)分別通入體積為2L的恒容密閉容器中,進行反應CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三組數(shù)據(jù):
①實驗1中從反應開始至平衡以CO2表示的平均反應速率為v(CO2)=實驗組 溫度/℃ 起始量/mol 平衡量/mol 達到平衡所需時間/min H2O CO H2 CO 1 650 2 4 1.6 2.4 6 2 900 1 2 0.4 1.6 3 3 900 a b c d t 。(取小數(shù)點后兩位,下同)
②該反應的正反應為(填“吸”或“放”)熱反應,實驗2條件下平衡常數(shù)K=。
③若實驗3達平衡時與實驗2平衡狀態(tài)中各物質(zhì)的體積分數(shù)分別相等,且t<3,則a、b應滿足的關(guān)系是。(用含a、b的代數(shù)式表示)
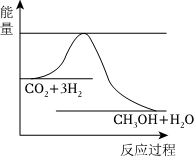
(3)目前工業(yè)上有一種方法是用CO2來生產(chǎn)甲醇。一定條件下發(fā)生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如圖表示該反應進行過程中能量(單位為kJ?mol-1)的變化。在體積為1L的恒容密閉容器中,充入1mol CO2和3mol H2,達到平衡后下列措施中能使c(CH3OH)增大的是。(填序號)
a.升高溫度
b.充入He(g),使體系壓強增大
c.將H2O(g)從體系中分離出來
d.再充入1mol CO2和3mol H2組卷:41引用:1難度:0.6 -
22.在學習了化學反應速率知識后,某研究性學習小組進行了科學探究活動.
[探究活動一]探究金屬與不同酸反應的反應速率:常溫下,用經(jīng)過砂紙打磨的鋁片中取兩片質(zhì)量相等、表面積相同的鋁片,分別加入到盛有體積相同、c(H+)相同,足量的稀硫酸和稀鹽酸溶液的兩支試管中,發(fā)現(xiàn)鋁片在稀鹽酸中消失的時間比在稀硫酸中短.
(1)對[探究活動一]實驗現(xiàn)象發(fā)生的原因,請你幫該研究性學習小組提出兩個假設:
假設Ⅰ.假設Ⅱ.
并請你設計實驗對以上假設進行驗證:
驗證假設Ⅰ.驗證假設Ⅱ.
[探究活動二]某小組在實驗室測定氨基甲酸銨(NH2COONH4)分解反應平衡常數(shù)和水解反應速率.
(2)將一定量純凈的氨基甲酸銨置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
實驗測得不同溫度下的平衡數(shù)據(jù)列于表:
①可以判斷該分解反應已經(jīng)達到化學平衡狀態(tài)的是溫度(℃) 15.0 20.0 25.0 30.0 35.0 平衡總壓強(kPa) 5.7 8.3 12.0 17.1 24.0 平衡氣體總濃度(×10-3mol/L) 2.4 3.4 4.8 6.8 9.4 .
A.2v(NH3)=v(CO2)B.密閉容器中總壓強不變
C.密閉容器中混合氣體的密度不變 D.密閉容器中氨氣的體積分數(shù)不變
②根據(jù)表中數(shù)據(jù),列式計算25.0℃時的分解平衡常數(shù):.
③取一定量的氨基甲酸銨固體放在一個帶活塞的密閉真空容器中,在25℃下達到分解平衡.若在恒溫下壓縮容器體積,氨基甲酸銨固體的質(zhì)量(填“增加”、“減小”或“不變”).
④氨基甲酸銨分解反應的焓變△H0,熵變△S 0(填>、<或=).
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3?H2O.該研究小組分別用三份不同初始濃度的氨基甲酸銨溶液測定水解反應速率,得到c(NH2COO-)隨時間變化趨勢如圖1所示.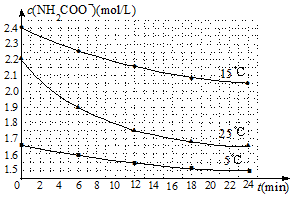
⑤計算25℃時,0~6min氨基甲酸銨水解反應的平均速率:.
⑥根據(jù)圖中信息,如何說明水解反應速率隨溫度升高而增大:.組卷:35引用:2難度:0.3


