2023-2024學年遼寧省大連市濱城高中聯盟高一(上)期中化學試卷
發布:2024/10/12 11:0:2
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項符合題目要求。
-
1.“中國名片”、“中國制造”發展在眾多領域受到世界矚目,它們與化學有著密切聯系。下列不正確的是( )
A.新型核潛艇“長征18”可以在海底潛伏數月之久,運用Na2O2作供氧劑 B.港珠澳大橋橋梁采用先進的抗腐蝕方法,鋼鐵橋梁被腐蝕是氧化還原反應 C.抗擊“新型冠狀病毒”過程中用到的“84”消毒液的有效成分是NaClO D.碳酸氫鈉可用于治療胃酸過多,與醋(CH3COOH)同服可提高療效 組卷:17引用:1難度:0.7 -
2.圖a~c分別為氯化鈉在不同狀態下的導電實驗(X、Y均表示石墨電極,X與電源正極相連,Y與電源負極相連)微觀示意圖,下列說法正確的是( )

A.圖示中 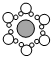 代表的是水合鈉離子
代表的是水合鈉離子B.氯化鈉只有在通電條件下才能電離 C.圖b表示熔融狀態下氯化鈉的導電過程 D.氯化鈉在不同狀態下均能導電 組卷:48引用:12難度:0.7 -
3.關于溶液配制,下列說法正確的是( )
A.配制480mL 0.1mol/LCuSO4溶液,需要稱量CuSO4?5H2O晶體12.0g B.用濃硫酸配制稀硫酸時,將濃硫酸稀釋后立即轉入容量瓶中 C.稱量5.3g碳酸鈉固體時,若將稱量物和砝碼放反,將會使稱量結果偏小 D.定容時俯視刻度線,可使配制物質的量濃度偏低 組卷:307引用:8難度:0.6 -
4.下列離子能大量共存的是( )
A.透明強酸性溶液中:K+、Na+、 、MnO-4SO2-4B.在NaOH溶液中:Na+、Cl-、 、SO2-4HCO-3C.含有大量Ba(NO3)2的溶液中:K+、Na+、 、Cl-CO2-3D.使紫色石蕊溶液呈紅色的溶液中:Na+、K+、 、HCO-3NO-3組卷:15引用:1難度:0.7 -
5.下列說法正確的是( )
①標準狀況下,6.02×1023個分子所占的體積約是22.4L
②0.5molH2所占體積為11.2L
③同溫同體積時,物質的物質的量越大,則壓強越大
④常溫常壓下,28gCO與N2的混合氣體所含的電子數為14NA
⑤各種氣體的氣體摩爾體積都約為22.4L?mol-1
⑥標準狀況下,體積相同的氣體的分子數相同
⑦同溫同壓下,氣體的密度與氣體的相對分子質量成正比A.①③⑤ B.④⑥⑦ C.③④⑥ D.①④⑥ 組卷:61引用:1難度:0.8 -
6.下列離子方程式正確的是( )
A.澄清石灰水與過量碳酸氫鈉溶液反應: +Ca2++OH-═CaCO3↓+H2OHCO-3B.硫酸氫鈉溶液中加入氫氧化鋇溶液至恰好沉淀完全:H++ +Ba2++OH-═BaSO4↓+H2OSO2-4C.Na與CuSO4溶液的反應:2Na+Cu2+═Cu+2Na+ D.碳酸氫鈉溶液中加入鹽酸: +2H+═CO2↑+H2OCO2-3組卷:13引用:1難度:0.7
二、非選擇題:本題共4小題,共55分。
-
18.氧化還原反應原理在生產、生活中應用廣泛。
(1)下列反應中不涉及氧化還原反應的是(填序號)。
a.蠟炬成灰
b.水滴石穿
c.食物腐敗
(2)某同學寫出以下化學反應方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,在3個反應中一定不可能實現的是(填序號)。
(3)ClO2可用于污水的殺菌和飲用水的凈化。KClO3與SO2在強酸性溶液中反應可制得ClO2,SO2被氧化為,此反應的離子方程式為SO2-4。
(4)亞硝酸鈉(NaNO2)是一種用途廣泛的工業鹽,因其外觀和食鹽相似容易誤食中毒,誤食NaNO2會導致人體血紅蛋白中的Fe2+轉化為Fe3+而中毒,該過程中NaNO2表現出的性質與下列(填序號)反應中H2O2表現出的性質相同(填序號)。
A.2H2O22H2O+O2↑MnO2
B.H2O3+H2SO4+2KI═2H2O+I2+K2SO4
C.H2O2+Cl2═2HCl+O2↑
D.5H2O2+2KMnO4+6HCl═2MnCl2+2KCl+5O2↑+8H2O
(5)已知亞硝酸鈉(NaNO2)可以與氯化銨(NH4Cl)反應生成氮氣、氯化鈉及其它產物,寫出該反應的化學反應方程式。
(6)一定條件下,當溶液中與H2O2物質的量比恰好為2:5時,溶液中XO-4離子被還原為較低價態,則X元素的化合價變為XO-4。組卷:22引用:1難度:0.6 -
19.“侯氏制堿法”促進了我國純堿工業的發展。某化學興趣小組在實驗室中模擬并改進侯氏制堿法用碳酸氫銨(NH4HCO3)和氯化鈉為主要原料制備碳酸鈉的實驗流程如圖。
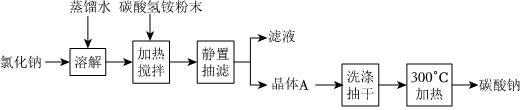
回答下列問題:
(1)“加熱攪拌”中發生反應的化學方程式是,該反應屬于(填基本反應類型)。
(2)“300℃加熱”需用到的儀器除酒精燈、坩堝、坩堝鉗、泥三角、三腳架外,還有。
(3)除去NaHCO3溶液中混有的少量Na2CO3的最佳方法是,化學方程式為。
(4)檢驗Na2CO3中陽離子的實驗方法是。
(5)現將Na2CO3和NaHCO3的固體均勻混合物等分成兩份。第一份充分加熱至恒重,固體質量減少6.2g;第二份與足量稀鹽酸充分反應后,加熱、蒸干、灼燒,得到固體23.4g。則混合物中Na2CO3和NaHCO3的物質的量之比為。
(6)若將Na2CO3和NaHCO3的固體混合物溶于水,向溶液中加入鹽酸,所加鹽酸的體積與產生CO2的體積關系如圖所示,則線段)|OA||AB|(填“>”“<”或“=”),OA段發生反應的離子方程式為。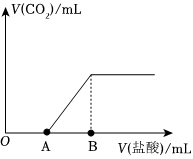 組卷:52引用:1難度:0.5
組卷:52引用:1難度:0.5


