2022-2023學年江蘇省蘇州市重點中學高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共13題,每題3分,共39分。每題只有一個選項最符合題意。
-
1.4NH3+5O2
4NO+6H2O是工業制備硝酸的重要反應之一。下列說法不正確的是( )催化劑△A.該反應叫作氨的催化氧化 B.NO在空氣中能穩定存在 C.NH3在反應中表現出還原性 D.該反應放出熱量 組卷:21引用:2難度:0.5 -
2.中國科學院制備出超小銅納米晶嵌入的氮摻雜碳納米片催化劑,該催化劑可用來實現高效電催化CO2轉化為所期望的新能源產物。下列說法正確的是( )
A.基態Cu原子外圍電子排布式為3d94s2 B.中子數為8的N原子可表示為 N87C.第一電離能大小:I1(C)<I1(N)<I1(O) D.CO2是非極性分子 組卷:41引用:2難度:0.6 -
3.下列有關氧化物的性質與用途具有對應關系的是( )
A.CaO具有吸水性,常用于食品干燥劑 B.ClO2是黃綠色氣體,可用于自來水消毒 C.MgO是堿性氧化物,可作為耐高溫材料 D.SiO2熔點高,可用來制造通訊光纜 組卷:8引用:2難度:0.7 -
4.閱讀下列資料,完成4~7題。
SO2既是大氣主要污染物之一,也是重要的化工原料,可用于硫酸的生產。對燃煤煙氣脫硫能有效減少對大氣的污染并實現資源化利用。方法1:用氨水將SO2先轉化為NH4HSO3,再氧化為(NH4)2SO4;方法2:用生物質熱解氣(主要成分為CO、CH4、H2)將SO2在高溫下還原為單質硫;方法3:用Na2SO3溶液吸收SO2生成NaHSO3,再加熱吸收液,使之重新生成亞硫酸鈉;方法4:用Na2SO4溶液吸收煙氣中SO2,使用惰性電極電解吸收后的溶液,H2SO3在陰極被還原為硫單質。
下列說法正確的是( )A.SO2的水溶液不能導電 B.SO2的鍵角比SO3的鍵角大 C.SO32-的空間結構為平面三角形 D.SO42-中S原子軌道雜化類型為sp3 組卷:14引用:0難度:0.50
二、非選擇題:共4題,共61分。
-
16.三氯化鉻(CrCl3)在工業上主要用作媒染劑和催化劑,Cr(OH)3常用于顏料、陶瓷、橡膠等工業,實驗室模擬工業上以BaCrO4Na2O2為原料制備CrCl3和Cr(OH)3。
(1)制備CrCl3。
取一定質量的BaCrO4和對應量的水加入到三頸瓶中,水浴加熱并攪拌,一段時間后同時加入過量濃鹽酸和無水乙醇充分反應,生成CrCl3并放出CO2氣體。
①上述反應的化學方程式為。
②上述反應中的乙醇與BaCrO4投料的物質的量比例大約為3:8,原因是。
(2)測定CrCl3的質量分數。
Ⅰ.稱取樣品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL樣品溶液于帶塞的錐形瓶中,加熱至沸后加入稍過量的,稀釋并加熱煮沸,再加入過量的硫酸酸化,將Cr3+氧化為Cr2O72-;再加入過量KI固體加塞搖勻,使鉻完全以Cr3+的形式存在。
Ⅲ.加入1mL淀粉溶液,用0.0250mol?L-1標準Na2S2O3溶液滴定至終點,平行測定3次,平均消耗標準Na2S2O3溶液24.00mL。
已知反應:Cr2O72-+I-+H+→I2+Cr3++H2O(未配平),I2+S2O32-→S4O62-+I-(未配平)。
①滴定終點的現象是。
②計算CrCl3的質量分數(寫出計算過程)。
(3)制備Cr(OH)3。
Cr(Ⅲ)的存在形態的物質的量分數隨溶液pH的分布如圖所示。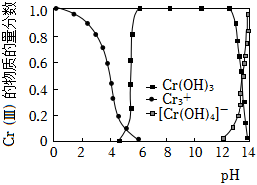
請補充完整由CrCl3溶液制備Cr(OH)3的實驗方案:取適量CrCl3溶液,,低溫烘干,得到Cr(OH)3晶體(實驗中須使用的試劑:1mol?L-1NaOH溶液、0.1mol?L-1AgNO3溶液、0.1mol?L-1HNO3溶液、蒸餾水)。組卷:12引用:2難度:0.4 -
 17.氫氣是一種理想的綠色清潔能源,氫氣的制取是氫能源利用領域的研究熱點。
17.氫氣是一種理想的綠色清潔能源,氫氣的制取是氫能源利用領域的研究熱點。
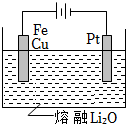
(1)用氧缺位鐵酸銅(CuFe2O4-x)作催化劑,利用太陽能熱化學循環分解H2O可制H2。
①氧缺位鐵酸銅通過兩步反應分解水制氫。已知第二步反應為:2CuFe2O4═2CuFe2O4-x+xO2↑,則第一步反應的化學方程式為。
②CuFe2O4可用電化學方法得到,其原理如圖所示,則陽極的電極反應式為。
(2)可利用FeO/Fe3O4之間的相互轉化,來裂解水制取氫氣,其制氫流程如圖所示。該工藝制氫的總反應為C(s)+H2O(g)═CO(g)+H2(g),對比水和碳在高溫下直接接觸反應制氫,分析該工藝制氫的最大優點是。
(3)硼氫化鈉(NaBH4)的強堿溶液在催化劑作用下與水反應可獲取氫氣,其可能反應機理如圖所示。已知:常溫下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式結晶析出。
①如圖所示的最后一個步驟反應機理可描述為。
②若用D2O代替H2O,依據反應機理,則反應后生成的氣體中含有。
③其他條件相同時,測得平均每克催化劑使用量下,NaBH4的濃度和放氫速率的變化關系如圖所示。隨著NaBH4濃度的增大,放氫速率先增大后減小,其原因可能是。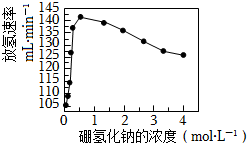 組卷:35引用:2難度:0.6
組卷:35引用:2難度:0.6


