2021-2022學年四川省成都外國語學校高二(下)月考化學試卷(3月份)
發(fā)布:2024/8/8 8:0:9
一.選擇題(共20個,2分/個,共40分,每題只有一個正確答案。)
-
1.根據所學習的電化學知識,下列說法正確的是( )
A.酸雨后鋼鐵易發(fā)生析氫腐蝕、鐵鍋存留鹽液時易發(fā)生吸氧腐蝕 B.鐵表面的鍍鋅層破損后,就完全失去了對鐵的保護作用 C.水庫的鋼閘門與電源正極連接可實現電化學保護 D.智能手機常用的鋰離子電池屬于一次電池 組卷:10引用:3難度:0.7 -
2.下列說法中正確的是( )
A.多電子原子的所有電子在同一區(qū)域里運動 B.能量高的電子在離核近的區(qū)域運動,能量低的電子在離核遠的區(qū)域運動 C.處于最低能量的原子叫基態(tài)原子 D.同一原子中,1a、2s、3s所能容納的電子數越來越多 組卷:3引用:2難度:0.7 -
3.下列化學用語正確的是( )
A.乙烯的結構簡式CH2CH2 B.氯化銨的電子式: 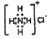
C.氟原子的結構示意圖: 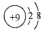
D.鉻原子的價電子軌道表示: 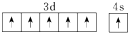 組卷:1引用:1難度:0.7
組卷:1引用:1難度:0.7 -
4.下列有關說法正確的是( )
A.所有非金屬元素都分布在p區(qū) B.電子云通常用小點的疏密程度來表示,小點密表示在該空間的電子數多 C.Cu的核外電子排布式為1s22s22p63s23p63d104s1,所以Cu處于s區(qū) D.已知Fe的價層電子排布式為3d64s2,Fe3+的價層電子排布式為3d5 組卷:25引用:2難度:0.8 -
5.燃料電池是燃料(如CO、H2、CH4、C2H6等)跟氧氣(或空氣)起反應將化學能轉變?yōu)殡娔艿难b置,若電解質溶液是強堿溶液,下面關于乙烷(C2H6)燃料電池的說法正確的是( )
A.該電池工作時,正極附近溶液的堿性增強 B.負極反應式:C2H6+18OH-+14e-=2CO32-+12H2O C.通入5.6LO2完全反應后,有1mol電子發(fā)生轉移 D.燃料電池的優(yōu)點之一是點燃時化學能大部分轉化為電能而不是熱能和光能 組卷:39引用:2難度:0.5 -
6.下列說法正確的是( )
A.6C的電子排布式1s22s22px2,違反了泡利不相容原理 B.價電子排布為5s25p2的元素位于第五周期第IIA族,是p區(qū)元素 C.ns電子的能量一定 高于(n-1)p電子的能量 D.電子排布式(23V) 1s22s22p53s23p63d34s2違反了洪特規(guī)則 組卷:76引用:2難度:0.8 -
7.常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.能使甲基橙變紅的溶液中:Na+、Al3+、 、I-NO-3B. =10-12的溶液中:c(OH-)c(H+)、Cu2+、NH+4、Cl-SO2-4C.水電離出的c(H+)=10-10mol?L-1的溶液中:Na+、K+、Cl-、 CO2-3D.含大量Fe3+的溶液中:Na+、K+、 、SO2-4HCO-3組卷:0引用:1難度:0.6 -
8.與甲、乙兩套裝置有關的下列說法正確的是( )
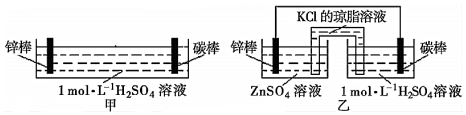
A.甲、乙裝置中,鋅棒均作負極,發(fā)生氧化反應 B.甲中鋅棒直接與稀H2SO4接觸,故甲生成氣泡的速率更快 C.甲、乙裝置的電解質溶液中,陽離子均向碳棒定向遷移 D.乙中鹽橋設計的優(yōu)點是迅速平衡電荷,提高電池效率 組卷:80引用:4難度:0.7
二.填空題(共5個題,60分)
-
24.硫氰化鉀 (KSCN)俗稱玫瑰紅酸鉀,是一種用途廣泛的化學藥品.主要用于合成樹脂、殺蟲殺菌劑、芥子油、硫脲類和藥物等.實驗室模擬工業(yè)以NH3和CS2為原料制備KSCN的實驗裝置如圖所示:
已知:①NH3不溶于CS2,CS2密度比水大且難溶于水;
②三頸燒瓶內盛放CS2、水和催化劑,發(fā)生反應:CS2+3NH3NH4SCN+NH4HS,該反應比較緩慢,且NH4SCN在高于170℃易分解。催化劑加熱
③KSCN的溶解度隨溫度變化較大。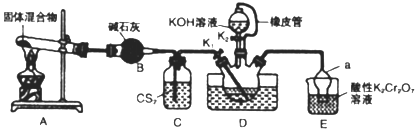
(1)A裝置中固體混合物是;儀器a的名稱。
(2)三頸燒瓶內的導氣管插入下層CS2液體中,原因是。
(3)待實驗中觀察到現象時,熄滅A處酒精燈,待D中無氣泡產生時關閉K1..保持三頸燒瓶內液溫105℃一段時間,使NH4HS═NH3↑+H2S↑進行完全后,打開K2,繼續(xù)保持液溫105℃,滴入適量的KOH溶液,寫出生成KSCN的化學方程式。
(4)裝置E的作用為吸收尾氣,防止污染環(huán)境,寫出吸收NH3的離子方程式。
(5)反應結束后將三頸燒瓶中的固體催化劑濾去,再、、(填操作),得到硫氰化鉀晶體。
(6)晶體中KSCN含量的測定:稱取10.00g樣品,配成1000mL溶液,量取20.00mL溶液于錐形瓶中,加入適量稀硝酸,再加入幾滴a作指示劑,用0.1000mol?L-1AgNO3標準溶液滴定,達到滴定終點時消耗AgNO3標準溶液18.00mL。(已知:滴定時發(fā)生的反應為SCN-+Ag+═AgSCN↓(白色))
①指示劑a為。
②晶體中KSCN的質量分數為。組卷:3引用:1難度:0.5 -
25.利用煉鋅礦渣[主要含鐵酸鎵Ga2(Fe2O4)3、鐵酸鋅ZnFe2O4]獲得3種金屬鹽,并進一步利用鎵鹽制備具有優(yōu)異光電性能的氮化鎵(GaN),部分工藝流程如圖:
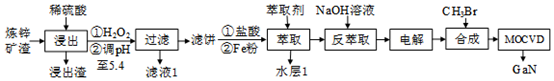
已知:①浸出液中金屬離子主要含Ga3+、Fe3+、Zn2+,含少量Fe2+。
②常溫下,浸出液中各離子的濃度及其開始形成氫氧化物沉淀的pH如表1。
③金屬離子在工藝條件下的萃取率(進入有機層中金屬離子的百分數)如表2。
表1 金屬離子濃度及開始沉淀的pH
表2 金屬離子的萃取率金屬離子 濃度/(mol?L-1) 開始沉淀pH Fe2+ 1.0×10-3 8.0 Fe3+ 4.0×10-2 1.7 Zn2+ 1.5 5.5 Ga3+ 3.0×10-3 3.0
(1)ZnFe2O4中Fe的化合價為金屬離子 萃取率 Fe2+ 0 Fe3+ 99% Zn2+ 0 Ga3+ 97%~98.5% ,調pH前加入H2O2的目的是。
(2)濾液1獲得的物質是(填化學式,下同),水層1獲得的物質是。
(3)Ga與Al化學性質相似。反萃取時,加入過量NaOH溶液后,Ga的存在形式是(填化學式)。
(4)電解過程包括電解反萃取液制粗鎵和粗鎵精煉兩個步驟。精煉時,以粗鎵為陽極,以NaOH溶液為電解液,陰極的電極反應為。
(5)GaN可采用MOCVD(金屬有機物化學氣相淀積)技術制得:以合成的三甲基鎵[Ga(CH3)3]與NH3發(fā)生反應得到GaN和另一種產物,該過程的化學方程式為。
(6)濾液1中殘余的Ga3+的濃度為mol?L-1。組卷:25引用:1難度:0.1


