2021-2022學年廣東省廣州十六中高二(上)月考化學試卷(11月份)
發布:2025/1/6 6:30:3
一、選擇題:本題共16小題,共44分。第1~10小題,每小題2分;第11~16小題,每小題2分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列關于氨水的說法正確的是( )
A.氨水是堿,其中不含H+ B.氨水的導電性比NaOH溶液弱 C.室溫下的稀氨水中,Kw=1×10-14 D.某瓶氨水的pH=9,說明氨水是弱電解質 組卷:42引用:2難度:0.8 -
2.下列能正確表示電離過程的是( )
A.HCOOH+H2O?HCOO-+H3O+ B.CO32-+H2O?HCO3-+OH- C.NH4Cl?NH4++Cl- D.H2CO3?CO32-+2H+ 組卷:19引用:1難度:0.8 -
3.化學與生活、生產密切相關。下列說法合理的是( )
A.將AlCl3溶液蒸干并灼燒可以制備無水AlCl3 B.家用電器起火時可用泡沫滅火器進行滅火 C.BaCO3是難溶電解質,可用作醫療上檢查腸胃的鋇餐 D.Na2CO3溶液呈堿性,加熱除油污效果更好 組卷:5引用:1難度:0.7 -
4.常溫下,下列說法正確的是( )
A.pH=4的醋酸中c(H+)=4.0mol?L-1 B.pH=2的鹽酸與pH=1的鹽酸中c(H+)之比為1:10 C.pH=1的鹽酸與pH=1的硫酸中c(H+)之比為1:2 D.0.1mol?L-1的醋酸與0.2mol?L-1的醋酸中c(H+)之比為1:2 組卷:107引用:3難度:0.8 -
5.用0.1000mol/LNaOH溶液滴定未知濃度的CH3COOH溶液,反應恰好完全時,下列敘述正確的是( )
A.溶液呈中性,可選用甲基橙或酚酞作指示劑 B.溶液呈中性,只能選用石蕊作指示劑 C.溶液呈酸性,可選用甲基橙作指示劑 D.溶液呈堿性,只能選用酚酞作指示劑 組卷:42引用:2難度:0.8 -
6.為了除去MgCl2酸性溶液中的Fe3+,可在加熱攪拌的條件下加入一種試劑,過濾后,再加入適量的鹽酸,這種試劑是( )
A.MgO B.NaOH C.Na2CO3 D.NH3?H2O 組卷:30引用:1難度:0.7
二、填空題:本題共4小題,共56分。
-
19.我國力爭于2030年前做到碳達峰,2060年前實現碳中和。CH4與CO2重整是CO2利用的研究熱點之一。該重整反應體系主要涉及以下反應:
a)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1
b)CO2(g)+H2(g)?CO(g)+H2O(g)△H2
c)CH4(g)?C(s)+2H2(g)△H3
d)2CO(g)?CO2(g)+C(s)△H4
e)CO(g)+H2(g)?H2O(g)+C(s)△H5
(1)根據蓋斯定律,反應a的△H1=( 寫出一個代數式即可)。
(2)上述反應體系在一定條件下建立平衡后,下列說法正確的有。
A.增大CO2與CH4的濃度,反應a、b、c的正反應速率都增加
B.移去部分C(s),反應c、d、e的平衡均向右移動
C.加入反應a的催化劑,可提高CH4的平衡轉化率
D.降低反應溫度,反應a~e的正、逆反應速率都減小
(3)一定條件下,CH4分解形成碳的反應歷程如圖1所示。該歷程分步進行,其中,第步的正反應活化能最大。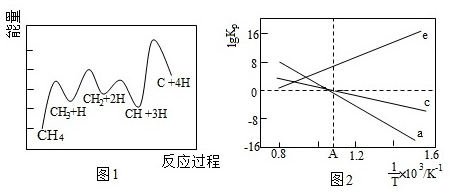
(4)反應a、c、e的lgKp隨(溫度的倒數)的變化如圖2所示。Kp為壓力平衡常數(即用平衡相對分壓代替平衡濃度,代入平衡常數表達式)。1T
①反應a、c、e中,屬吸熱反應的有(填字母)。
②在圖中A點對應溫度下、原料組成為n(CO2):n(CH4)=1:1、初始總壓為120kPa的恒容密閉容器中進行反應,體系達到平衡時H2的分壓為40kPa。計算CH4的平衡轉化率。
(5)某種CH4燃料電池部分工作原理如圖3所示: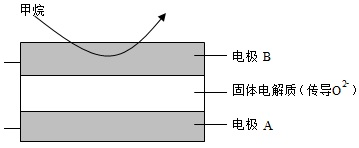
電極A為極,電極B上的電極反應式為。組卷:11引用:1難度:0.4 -
20.研究碳、氮、硫及其化合物的轉化對改善環境有重大意義。回答下列問題:
(1)某處碳循環如圖所示,CaCO3轉化為HCO3-的離子方程式為。結合平衡移動原理分析CaCO3溶解的原因。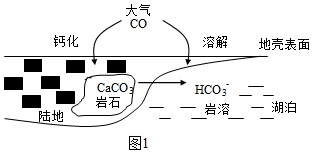
(2)利用“亞硫酸鹽法”吸收工業廢氣中的SO2。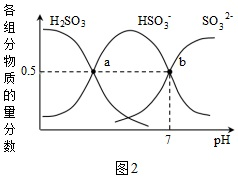
①常溫下,將工業廢氣通入(NH4)2SO3溶液中,測得溶液PH與含硫組分物質的量分數()的變化關系如圖所示。Ka2(H2SO3)=c(x)c(H2SO3)+c(HSO-3)+c(SO2-3)。b點溶液中n(NH4+):n(SO32-)=。
②常溫下,Ka1(H2SO3)=1.5×10-2;Kb(NH3?H2O)=1.8×10-5。0.1mol?L-1的(NH4)2SO3溶液中離子濃度由大到小順序為(不考慮OH)
(3)羰基硫(COS)是一種糧食熏蒸劑,能防治某些害蟲和真菌的危害。用COS處理過的糧食食用前需水洗,水洗時COS轉為兩種酸性氣體,該反應的化學方程式為。
(4)利用電解燒堿和食鹽的混合液使工業廢氣脫氮。NO被陽極產生的氣體氧化為NO3-,反應的離子方程式為。組卷:11引用:1難度:0.7


