2021-2022學年遼寧省沈陽二十二中高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共60分)每小題只有一個選項(每題3分,共60分)
-
1.下列說法正確的是( )
A.非自發反應在外加條件下可能實現 B.吸熱反應都不能自發進行 C.熵增加的反應都是自發反應 D.分子之間的碰撞一定能發生化學反應 組卷:9引用:5難度:0.7 -
2.對于反應COCl2(g)?CO(g)+Cl2(g)△H>0。改變下列條件一定不能加快反應速率的是( )
A.壓縮體積 B.增加CO濃度 C.加催化劑 D.恒容下通入惰性氣體 組卷:33引用:4難度:0.5 -
3.我國科研人員提出了由CO2和CH4轉化為高附加值產品CH3COOH的催化反應歷程,該歷程示意圖如圖所示,下列說法不正確的是( )
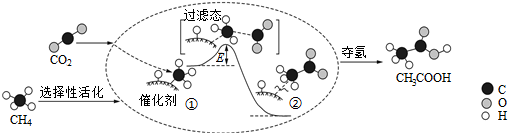
A.生成CH3COOH總反應的原子利用率為100% B.CH4→CH3COOH過程中,有C-H鍵發生斷裂 C.過程①→②吸收能量并形成了C-C鍵 D.該催化劑提高了反應速率 組卷:16引用:2難度:0.8 -
4.把下列四種NaOH溶液分別加入四個盛有10mL2mol?L-1鹽酸的燒杯中,均加水稀釋到50mL,此時,NaOH和鹽酸緩慢地進行反應,其中反應最快的是( )
A.20℃30mL2mol?L-1的NaOH溶液 B.20℃10mL4mol?L-1的NaOH溶液 C.10℃20mL3mol?L-1的NaOH溶液 D.10℃10mL2mol?L-1的NaOH溶液 組卷:18引用:2難度:0.7 -
5.化學反應O2 (g)+2SO2 (g)?2SO3 (g)在硫酸工業中有重要應用。關于該反應的敘述正確的是( )
A.無限延長化學反應的時間能改變化學反應的限度 B.O2、SO2、SO3的物質的量比1:2:2時達到平衡狀態 C.該反應達到化學平衡狀態時,正反應速率和逆反應速率相等且等于零 D.若開始加入SO2和18O2,達到化學平衡時核素18O存在于三種物質中 組卷:63引用:5難度:0.7 -
6.下列事實能用勒夏特列原理解釋的是( )
A.實驗室采用排飽和食鹽水的方法收集Cl2 B.500℃左右的溫度比室溫更有利于合成氨反應 C.H2、I2、HI平衡混合氣體加壓后顏色加深 D.SO2氧化為SO3,往往需要使用催化劑 組卷:11引用:2難度:0.7 -
7.下列關于化學反應速率的說法正確的是( )
①恒溫時,增大壓強,化學反應速率一定加快
②其他條件不變,溫度越高,化學反應速率越快
③使用催化劑可改變反應速率,從而改變該反應過程中吸收或放出的熱量
④3mol?L-1?s-1的反應速率一定比1mol?L-1?s-1的反應速率大
⑤有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加單位體積內活化分子數,從而使反應速率增大
⑥增大反應物濃度,可增大活化分子的百分數,從而使單位時間有效碰撞次數增多A.②⑥ B.②⑤ C.①②③⑤ D.①②④⑤ 組卷:228引用:17難度:0.9 -
8.某溫度下,在一恒容容器中發生反應3X(g)+Y(g)?2Z(g),下列敘述能證明該反應已經達到化學平衡狀態的是( )
A.容器內氣體密度不再變化 B.Y的體積分數不再變化 C.v(X):v(Y)=3:1 D.單位時間內消耗3nmolX同時生成2nmolZ 組卷:9引用:2難度:0.5
二、非選擇題
-
 23.氮元素可形成多種化合物,在工業生產中具有重要價值。請回答下列問題:
23.氮元素可形成多種化合物,在工業生產中具有重要價值。請回答下列問題:
(1)一定溫度下,2L密閉容器中充入0.40molN2O4,發生反應:N2O4(g)?2NO2(g),一段時間后達到平衡,測得數據如下:
①20s內,v(NO2)=時間/s 20 40 60 80 100 c(NO2)/(mol/L) 0.12 0.20 0.26 0.30 0.30 mol?L-1?s-1。
②升高溫度時,氣體顏色加深,則正反應是(填“放熱”或“吸熱”)反應。
③該溫度下反應的化學平衡常數數值為。
④相同溫度下,若開始向該容器中充入0.80molNO2,則達到平衡后:c(NO2)0.30mol?L-1(填“>”、“=”或“<”)。
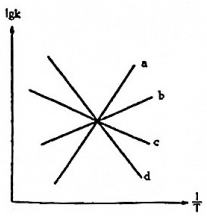
(2)已知2C(s)+2NO2(g)?N2(g)+2CO2 ΔH<0的正反應速率方程為v正=k正?p(NO2),逆反應速率方程式為v逆=k逆?p(N2)?p2(CO2),其中k正、k逆分別為正逆反應速率常數,如圖(lgk表示速率常數的對數,表示溫度的倒數)所示a、b、c、d四條斜線中,能表示lgk正隨1T變化關系的斜線是1T,能表示lgk逆隨變化關系的斜線是1T。組卷:8引用:1難度:0.4 -
24.已知化學反應①:Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常數為K1;化學反應②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常數K2.在溫度973K和1173K情況下,K1、K2的值分別如下:
(1)通常表格中的數值可以推斷:反應①是溫度 K1 K2 973K 1.47 2.38 1173K 2.15 1.67 (填“吸熱”或“放熱”)反應.
(2)現有反應③:CO2(g)+H2(g)=CO(g)+H2O(g),請你寫出該反應的平衡常數K3的數學表達式:K3=.
(3)根據反應①與②可推導出K1、K2與K3之間的關系式.據此關系式及上表數據,也能推斷出反應③是(填“吸熱”或“放熱”)反應,要使反應③在一定條件下建立的平衡向正反應方向移動,可采取的措施有(填寫序號).
A.縮小反應容器容積 B.擴大反應容器容積 C.降低溫度 D.升高溫度
E.使用合適的催化劑 F.設法減少CO的濃度.組卷:19引用:7難度:0.3


