2021-2022學(xué)年四川省成都外國語學(xué)校高二(上)月考化學(xué)試卷(10月份)
發(fā)布:2024/12/29 18:30:3
一、選擇題(共25個(gè),2分/個(gè),共50分,每題只有一個(gè)正確答案。)
-
1.下列說法中錯(cuò)誤的是( )
A.神舟十二號(hào)載人飛船的燃料燃燒時(shí)主要將化學(xué)能轉(zhuǎn)化為熱能 B.《黃帝內(nèi)經(jīng)》說:“五谷為養(yǎng),五果為助”,面粉、水果的主要成分是油脂 C.陸游的詩句“紙上得來終覺淺”中,“紙”的主要成分是纖維素 D.“青如天、明如鏡、聲如磬”的漢代瓷器,是黏土經(jīng)高溫?zé)Y(jié)而成 組卷:39引用:2難度:0.7 -
2.設(shè)NA表示阿伏加德羅常數(shù)的值,下列說法正確的是( )
A.等體積的CO2和CO,分子數(shù)目均為NA B.標(biāo)準(zhǔn)狀況下,22.4L的H2和22.4L的F2混合后,氣體分子數(shù)為2NA C.有鐵粉參加的反應(yīng)若生成3molFe2+,則轉(zhuǎn)移電子數(shù)為6NA D.10.1gN(C2H5)3中所含的極性共價(jià)鍵數(shù)目為1.8NA 組卷:7引用:1難度:0.5 -
3.下列反應(yīng)的離子方程式正確的是( )
A.等物質(zhì)的量的Ba(OH)2與NH4HSO4在稀溶液中反應(yīng):Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O B.硫代硫酸鈉溶液與稀硫酸混合出現(xiàn)渾濁:S2O32-+2H+═S↓+SO2↑+H2O C.酸性高錳酸鉀溶液與草酸反應(yīng):2MnO4-+8H++3C2O42-═6CO2↑+2MnO2+4H2O D.向碳酸氫鈉溶液中滴入少量澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O 組卷:17引用:1難度:0.5 -
4.下列事實(shí)對(duì)應(yīng)的化學(xué)用語表達(dá)錯(cuò)誤的是( )
A.自然界中正常的雨水顯酸性:H2O+CO2?H2CO3,H2CO3?H++HCO3- B.“NO2球”浸入冷水中顏色變淺:2NO2(g)(紅棕色)?N2O4(g)(無色)△H<0 C.硫代硫酸鈉溶液與稀硫酸混合出現(xiàn)渾濁:S2O32-+2H+═S↓+SO2↑+H2O D.甲烷的燃燒熱為△H=-890.3kJ?mol-1,則甲烷燃燒的熱化學(xué)方程式為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 組卷:32引用:3難度:0.5 -
5.下列關(guān)于化學(xué)反應(yīng)速率及化學(xué)平衡的說法,正確的是( )
A.升高溫度能增大單位體積內(nèi)活化分子數(shù)目,加快反應(yīng)速率 B.增大反應(yīng)物濃度,可增大活化分子的百分?jǐn)?shù),因而反應(yīng)速率加快 C.化學(xué)反應(yīng)條件改變,已處于化學(xué)平衡的可逆反應(yīng)一定發(fā)生平衡移動(dòng) D.催化劑可以提高化學(xué)反應(yīng)的選擇性,進(jìn)而提高反應(yīng)物的平衡轉(zhuǎn)化率 組卷:45引用:3難度:0.6 -
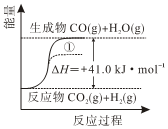 6.已知:H2O(g)═H2O(l) ΔH=-44.0 kJ?mol?1,根據(jù)如圖反應(yīng)過程的能量變化示意圖判斷,下列說法正確的是( )
6.已知:H2O(g)═H2O(l) ΔH=-44.0 kJ?mol?1,根據(jù)如圖反應(yīng)過程的能量變化示意圖判斷,下列說法正確的是( )A.1molCO和1molH2O完全反應(yīng)吸熱41kJ B.使用催化劑使反應(yīng)歷程改變,能量變化曲線可能為① C.升高溫度,使反應(yīng)CO2(g)+H2(g)?CO(g)+H2O(g)向逆反應(yīng)方向移動(dòng) D.CO2(g)+H2(g)?CO(g)+H2O(l)是放熱反應(yīng) 組卷:11引用:1難度:0.5 -
7.下列圖示裝置能達(dá)到實(shí)驗(yàn)?zāi)康牡氖牵ā 。?/h2>
A. 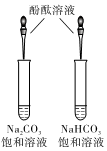
如圖比較CO32-和HCO3-水解能力的強(qiáng)弱B. 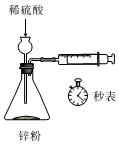
如圖測定鋅與稀硫酸的反應(yīng)速率C. 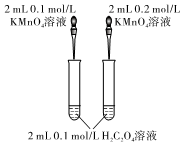
如圖研究濃度對(duì)反應(yīng)速率的影響D. 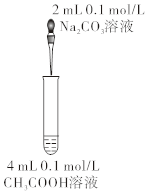
如圖比較碳酸和醋酸的酸性強(qiáng)弱組卷:17引用:5難度:0.5 -
8.下列事實(shí)不能用勒夏特列原理解釋的是( )
A.我國工業(yè)合成氨一般采用20MPa~50MPa的高壓 B.SO2催化氧化制SO3的過程中使用過量的氧氣,以提高二氧化硫的轉(zhuǎn)化率 C.CO(g)+NO2(g)?CO2(g)+NO(g) 達(dá)平衡后,縮小容器體積可使顏色變深 D.向K2Cr2O7溶液中滴入3~10滴濃硫酸,溶液橙色加深 組卷:32引用:4難度:0.6 -
9.對(duì)于可逆反應(yīng)A(g)+3B(s)?C(g)+2D(g),在不同條件下的化學(xué)反應(yīng)速率如下,其中表示的反應(yīng)速率最快的是( )
A.v(C)=0.1mol?L-1?s-1 B.v(B)=1.2mol?L-1?s-1 C.v(A)=2mol?L-1?min-1 D.v(D)=0.4mol?L-1?min-1 組卷:15引用:1難度:0.5 -
10.在同溫同壓下,下列各組熱化學(xué)方程式中,△H1>△H2的是( )
A.2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 B.S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 C.C(s)+ O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H212D.H2(g)+Cl2(g)═2HCl(g)△H1 H2(g)+12Cl2(g)═HCl(g)△H212組卷:127引用:12難度:0.7
二.填空題(共4個(gè)題,50分)
-
29.研究CO2的利用對(duì)促進(jìn)低碳社會(huì)的構(gòu)建具有重要的意義。
(1)已知石墨的標(biāo)準(zhǔn)燃燒熱為ykJ?mol-1,1.2g石墨在1.68L(標(biāo)準(zhǔn)狀況)氧氣中燃燒,至反應(yīng)物耗盡,放出xkJ熱量。則石墨與氧氣反應(yīng)生成CO的熱化學(xué)方程式為:。
(2)高溫時(shí),用CO還原MgSO4可制備高純MgO。750℃時(shí),測得氣體中含等物質(zhì)的量SO2和SO3,此時(shí)反應(yīng)的化學(xué)方程式是:。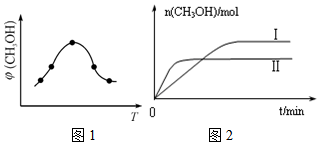
(3)二氧化碳合成甲醇是碳減排的新方向,將CO2轉(zhuǎn)化為甲醇的熱化學(xué)方程式為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①取五份等體積CO2和H2的混合氣體(物質(zhì)的量之比均為1:3),分別加入溫度不同、容積相同的恒容密閉容器中,發(fā)生上述反應(yīng),反應(yīng)相同時(shí)間后,測得甲醇的體積分?jǐn)?shù)φ(CH3OH)與反應(yīng)溫度T的關(guān)系曲線如圖1所示,則上述CO2轉(zhuǎn)化為甲醇反應(yīng)的ΔH(填“>”“<”或“=”)0。
②在兩種不同條件下發(fā)生反應(yīng),測得CH3OH的物質(zhì)的量隨時(shí)間變化如圖2所示,曲線I、Ⅱ?qū)?yīng)的轉(zhuǎn)化率大小關(guān)系為aⅠaⅡ(填“>”“<”或“=”)。組卷:22引用:1難度:0.6 -
30.Deacon直接氧化法可將HCl轉(zhuǎn)化為Cl2,提高效益,減少污染,反應(yīng)原理為:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)。
(1)Deacon直接氧化法可按下列催化過程進(jìn)行:
CuCl2(s)═CuCl(s)+Cl2(g)ΔH1=+83kJ?mol-112
CuCl(s)+O2(g)═CuO(s)+12Cl2(g)ΔH2=-20kJ?mol-112
CuO(s)+2HCl(g)═CuCl2(s)+H2O(g)ΔH3=-121kJ?mol-1
則上述總反應(yīng)的熱化學(xué)方程式為。
(2)在一剛性容器中,當(dāng)進(jìn)料濃度比c(HCl):c(O2)=4:1時(shí),實(shí)驗(yàn)測得HCl平衡轉(zhuǎn)化率隨溫度變化的α(HCl)-T曲線如圖1: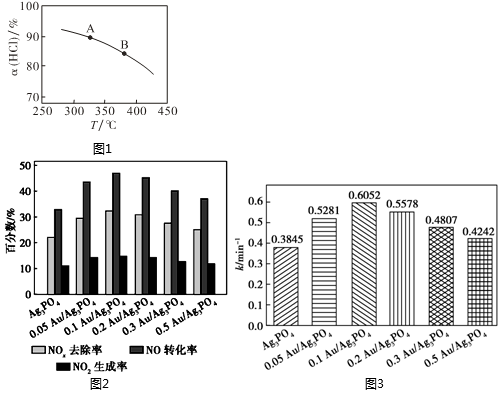
①一定溫度下,下列選項(xiàng)表明該反應(yīng)一定達(dá)到平衡狀態(tài)的是(填標(biāo)號(hào))。
A.HCl與O2的物質(zhì)的量之比不改變
B.HCl與Cl2的物質(zhì)的量之比不改變
C.容器內(nèi)的壓強(qiáng)不再改變
D.斷裂nmolH-Cl鍵的同時(shí)形成nmolH-O鍵
E.混合氣體的平均相對(duì)分子質(zhì)量不變
②在相同容器中若進(jìn)料濃度比c(HCl):c(O2)=1:1時(shí),所得α(HCl)-T曲線在曲線AB的方(填“上”或“下”)。
③溫度不變時(shí),進(jìn)一步提高HCl的轉(zhuǎn)化率的方法是、。(寫出2種)。
(3)若在一定溫度的剛性容器中投入原料HCl和O2的混合物發(fā)生反應(yīng),測得反應(yīng)過程中c(Cl2)的數(shù)據(jù)如下:
2,0~6.0min內(nèi)以HCl表示的反應(yīng)速率為t/min 0 2.0 4.0 6.0 8.0 10.0 c(Cl2)/10-3mol?L-1 0 1.8 3.7 5.4 7.2 8.3 。
(4)利用Au/Ag3PO4光催化去除氮氧化物(O2將氮氧化物氧化為NO3-),研究表明,不同Au的負(fù)載量與氮氧化物的去除效果、催化去除速率常數(shù)(用k表示,其他條件不變時(shí),速率常數(shù)越大,速率越大)大小的關(guān)系分別如圖2、圖3表示。已知:催化劑的活性與其表面的單位面積活性位點(diǎn)數(shù)有關(guān)。
①綜合圖1、圖2可知催化效果最佳的是(填催化劑)。
②圖2中表面隨著Au的負(fù)載量不斷增加,反應(yīng)速率常數(shù)先增大后減小,試分析反應(yīng)速率常數(shù)減小的原因是。組卷:19引用:1難度:0.6


