2021-2022學(xué)年四川省成都七中高一(下)期末化學(xué)試卷
發(fā)布:2024/11/10 6:30:2
一、單項選擇題(共20小題,每小題2分,滴分40分)
-
1.NA為阿伏加德羅常數(shù)的值。下列說法錯誤的是( )
A.19g18OH-中,質(zhì)子數(shù)、中子數(shù)和電子數(shù)分別是9NA、10NA、10NA B.100g質(zhì)量分數(shù)12%的乙酸溶液中H+的數(shù)目是0.2NA C.11g乙醛和環(huán)氧乙烷中H原子的數(shù)目是NA D.100g質(zhì)量分數(shù)46%的乙醇溶液含有O-H的數(shù)目是7NA 組卷:19引用:2難度:0.6 -
2.氚3H且具有放射性,半衰期為12.43年,工業(yè)上利用反應(yīng)堆產(chǎn)生的中子轟擊6Li化合物的靶材生產(chǎn)氣。重水(D2O,熔點3.8℃、沸點101.4℃)是H2O的一種同位素異構(gòu)體。下列說法錯誤的是( )
A.氫氣共有6種同位素異構(gòu)體,它們的熔點、沸點互不相同 B.重水分子間存在氫鍵和范德華力,且分子間作用力大于H2O分子 C.工業(yè)生產(chǎn)氚的過程不屬于化學(xué)變化 D.核廢水中的氚衰變完全需要接近25年,對環(huán)境有長期危害 組卷:13引用:2難度:0.9 -
3.化學(xué)與生活緊密相關(guān)。下列說法不正確的是( )
A.家用天然氣中,常摻入少量有特殊氣味的雜質(zhì)氣體 B.從石油中獲得乙烯,是目前生產(chǎn)乙烯的主要途徑 C.全氟代烷可溶解氧氣,可能成為未來的人造血液 D.煤經(jīng)氣化和液化兩個物理變化過程,可變?yōu)榍鍧嵞茉?/label> 組卷:18引用:2難度:0.7 -
4.圖示或化學(xué)用語表達正確的是( )
A.過氧化氫的比例模型: 
B.中子數(shù)為127的碘原子: I12753C.原子結(jié)構(gòu)示意圖 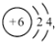 ,可以表示12C和14C
,可以表示12C和14CD.NaClO的電子式: 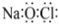 組卷:27引用:5難度:0.7
組卷:27引用:5難度:0.7 -
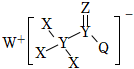 5.一種用于合成治療免疫疾病藥的物質(zhì),其結(jié)構(gòu)如圖所示,其中X、Y、Z、Q、W為1~20號元素且原子序數(shù)依次增大,Z與Q同主族,Q和W的簡單離子具有相同的電子層結(jié)構(gòu)。下列敘述錯誤的是( )
5.一種用于合成治療免疫疾病藥的物質(zhì),其結(jié)構(gòu)如圖所示,其中X、Y、Z、Q、W為1~20號元素且原子序數(shù)依次增大,Z與Q同主族,Q和W的簡單離子具有相同的電子層結(jié)構(gòu)。下列敘述錯誤的是( )A.Y的氫化物的熔點一定低于Z的氫化物的熔點 B.該物質(zhì)中Y、Z、Q均滿足8電子構(gòu)型 C.原子半徑:W>Q>Y>Z>X D.WX與Q的最高價氧化物對應(yīng)水化物的稀溶液反應(yīng)有無色無味氣體產(chǎn)生 組卷:24引用:2難度:0.7 -
6.部分含S及含Cl物質(zhì)的價類關(guān)系如圖所示,下列推斷錯誤的是( )
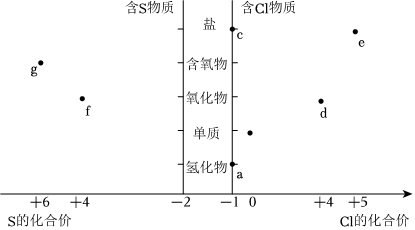
A.a(chǎn)的濃溶液和鉀鹽e反應(yīng),氧化劑與還原劑物質(zhì)的量之比為1:5 B.將b通入f的水溶液中發(fā)生反應(yīng),可以生成兩種強酸 C.加熱g的濃溶液和固態(tài)鈉鹽c的混合物生成a,說明酸性:g>a D.d和f都可以用于殺菌消毒 組卷:28引用:1難度:0.7 -
7.已知短周期主族元素R、W、X、Y、Z,其中R元素所在的周期數(shù)是其族序數(shù)的一半,且對應(yīng)的兩種常見氧化物均為酸性氧化物,W元素與Z元素在同一主族,X與其同主族另一元素單質(zhì)構(gòu)成原子反應(yīng)堆導(dǎo)熱劑,Y元素原子最外層電子數(shù)為m,次外層電子數(shù)為n,Z元素原子L層電子數(shù)為m+n,M層電子數(shù)為m-n,下列敘述中錯誤的是( )
A.R、X、Y對應(yīng)的簡單離子半徑:r(X)<r(Y)<r(R) B.相同溫度相同濃度的W、R的最高價含氧酸的正鹽溶液的堿性:W>R C.將WY2與RY2分別通入Ba(NO3)2溶液中,現(xiàn)象不同 D.因氫化物的穩(wěn)定性:Y>R,故氫化物的沸點:Y>R 組卷:24引用:2難度:0.7 -
8.實驗室用下列裝置模擬侯氏制堿法制取少量NaHCO3固體。不能達到實驗?zāi)康牡氖牵ā 。?br />
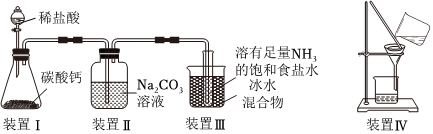
A.裝置Ⅰ制取CO2 B.裝置Ⅱ中Na2CO3溶液可除去CO2中的少量HCl C.裝置Ⅲ中冰水浴有利于析出NaHCO3固體 D.裝置Ⅳ可獲得少量NaHCO3固體 組卷:46引用:5難度:0.5
二、非選擇題(共4小題,滿分60分)
-
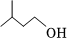
23.乙酸異戊酯具有香蕉的氣味,實驗室合成乙酸異戊酯的反應(yīng)和實驗裝置(省略了夾持裝置和帶有電磁攪拌功能的水浴鍋裝置)如圖。
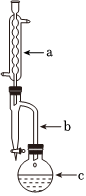
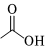 +
+ H2SO4△
H2SO4△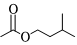 +H2O
+H2O
有關(guān)試劑和產(chǎn)物的性質(zhì)如下:
Ⅰ.合成反應(yīng)相對分子質(zhì)量 密度/(g?cm-3) 沸點/℃ 熔點/℃ 溶解性 異戊醇 88 0.8123 131 -117 微溶于水 冰乙酸 60 1.0492 118 16.5 易溶于水 乙酸異戊酯 130 0.8825 142 -79 微溶于水 濃硫酸 98 1.84 338 10.36 易溶于水 環(huán)己烷 84 0.79 81 6.5 難溶于水
在儀器c(圓底燒瓶)中加入60mL異戊醇、4mL冰醋酸、0.6mL濃硫酸、25mL環(huán)己烷和磁力攪拌子;搖勻后裝上儀器b(分水器),向b中加入環(huán)己烷至支管處,接好儀器a(球形冷凝管),通冷凝水,打開電磁攪拌器,水浴加熱回流約1~1.5h。由于環(huán)己烷和水可以形成二元最低共沸物,因此生成的水不斷地被環(huán)己烷從反應(yīng)混合液中帶出來。
Ⅱ.分離提純
將冷至室溫的反應(yīng)液倒入分液漏斗中,用25mL水洗一次,再用5%NaHCO3溶液洗至中性,最后用5mL飽和食鹽水洗一次,有機相加入無水MgSO4靜置,過濾,將有機相蒸餾,先收集環(huán)己烷,再收集138~142℃的餾分,共4.50g。
回答下列問題:
(1)根據(jù)上述藥品用量,下列圓底燒瓶最合適的規(guī)格為,分液漏斗最合適的規(guī)格為。
A.100mL
B.250mL
C.500mL
D.1000mL
(2)回流時,氣霧上升高度不宜超過冷凝管高度的。若氣霧上升過高,可采取的措施是13。
(3)反應(yīng)中分水器內(nèi)可觀察到液體分層,至下層液體液面不再升高時,可判斷反應(yīng)已經(jīng)完成,原因是。
(4)加入環(huán)己烷的目的除了共沸帶水外,還可降低體系回流溫度,減少副反應(yīng);若溫度過高,主要有機副產(chǎn)物有:2-甲基-2-丁烯、和(寫出結(jié)構(gòu)簡式)。
(5)磁力攪拌子的作用是攪拌和。
(6)關(guān)于Ⅱ.分離提純的說法,不正確的是。
A.用25mL水洗可降低有機相中酸的濃度
B.NaHCO3溶液洗的目的是除掉有機相中的酸
C.無水MgSO4的作用是除掉有機物中的水
D.分液時,有機相從分液漏斗下口放出
E.靜置后可不過濾,直接蒸餾分離有機物
F.蒸出的環(huán)己烷可重復(fù)利用
(7)該反應(yīng)的產(chǎn)率最接近。
A.52%
B.62%
C.72%
D.82%組卷:35引用:2難度:0.5 -
24.用軟錳礦(主要成分為MnO2,含少量Fe3O4、Al2O3)和BaS制備高純MnCO3的工藝流程如圖:
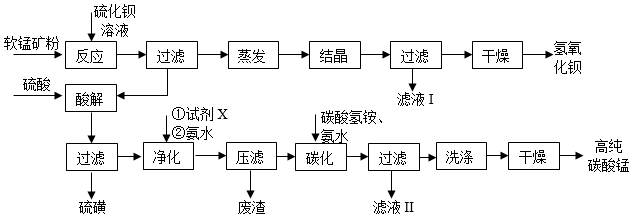
已知:MnO2是一種兩性氧化物;
25℃時金屬陽離子開始沉淀和完全沉淀時溶液的pH如下表。
*Fe(OH)2沉淀呈絮狀,不易從溶液中過濾除去。回答下列問題:物質(zhì) Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2 開始沉淀 7.6 2.7 3.2 8.3 完全沉淀 9.6* 3.7 4.9 9.8
(1)錳元素位于元素周期表第周期。
(2)軟錳礦預(yù)先粉碎的目的是,MnO2與BaS溶液反應(yīng)轉(zhuǎn)化為MnO的化學(xué)方程式為。
(3)保持BaS投料量不變,隨MnO2與BaS投料比增大,S的量達到最大值后無明顯變化,而Ba(OH)2的量達到最大值后會減小,減小的原因是。
(4)濾液Ⅰ可循環(huán)使用,應(yīng)當將其導(dǎo)入到操作中(填操作單元的名稱)。
(5)凈化時需先加入的試劑X為(填化學(xué)式)。再使用氨水調(diào)溶液的pH,則pH的理論最小值為。
(6)碳化過程中發(fā)生反應(yīng)的離子方程式為。組卷:62引用:2難度:0.4


