2022-2023學年黑龍江省哈爾濱九中高二(上)期中化學試卷(12月份段考)
發布:2024/9/19 1:0:9
一單項選擇題(每小題只有1個選項符合題意,每題2分,共36分)
-
1.化學與生活密切相關。下列說法錯誤的是( )
A.絮凝劑有助于去除生活廢水中的懸浮物,CaSO4?2H2O,KAl(SO4)2?12H2O均可作為絮凝劑 B.可以通過勒夏特列原理解釋夏天打開啤酒蓋,噴出大量泡沫的現象 C.食品放入冰箱中,因為溫度低,變質速率低所以食品能夠保存較長時間 D.需要加熱才能進行的化學反應不一定是吸熱反應 組卷:4引用:1難度:0.6 -
2.下列敘述正確的是( )
A.甲烷的燃燒熱為ΔH=-890.3kJ?mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ?mol-1 B.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ?mol-1,則稀H2SO4溶液和稀Ba(OH)2溶液反應的反應熱ΔH=2×(-57.3)kJ?mol-1 C.CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的ΔH=+(2×283.0)kJ/mol D.2SO2(g)+O2(g)?2SO3(g)ΔH=-196.3kJ?mol-1,則1molSO2、0.5molO2充分反應后,放出熱量98.3kJ 組卷:21引用:4難度:0.6 -
3.根據下列實驗及現象,能量關系正確的是( )
實驗及現象 能量關系 A 將“NO2球”置于熱水中,紅棕色加深 N2O4(g)?2NO2(g)△H<0 B NaOH與HCl溶液混合,溶液溫度升高 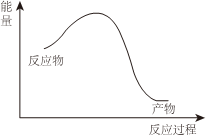
C 鈉投入水中,熔化成小球 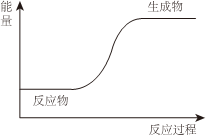
D 微熱含酚酞的Na2CO3溶液,紅色加深 (aq)+H2O(l)?CO2-3(aq)+OH-(aq)△H<0HCO-3A.A B.B C.C D.D 組卷:110引用:5難度:0.9 -
4.下列實驗操作能達到實驗目的的是( )
A.0.01mol?L-1的鹽酸,用pH試紙可測量其pH=2.0 B.用規格為50.00mL的堿式滴定管量取20.00mL氫氧化鈉溶液時,將初始讀數調整到30.00mL,然后將滴定管內剩余溶液全部放出即可 C.蒸干AlCl3溶液可制備無水AlCl3固體 D.實驗室將FeCl3晶體溶于較濃鹽酸再加水稀釋到所需濃度來配制該溶液,可抑制FeCl3的水解 組卷:1引用:1難度:0.5 -
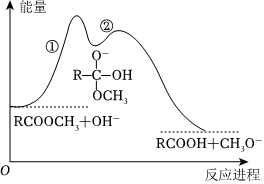 5.酯在堿溶液中水解反應歷程如圖所示。下列說法錯誤的是( )
5.酯在堿溶液中水解反應歷程如圖所示。下列說法錯誤的是( )A.活化能:反應①>反應② B.反應①和②、總反應的ΔH都小于0 C.反應①決定酯在堿溶液中水解的總速率 D.其他條件相同,增大堿的濃度能提高酯水解速率 組卷:7引用:3難度:0.6 -
6.在一定條件下,某反應達到平衡時,平衡常數K=
。恒容時,若溫度適當降低,D的濃度增加。下列說法正確的是( )c(A)?c(B)c(C)?c(D)A.降低溫度,逆反應速率增大 B.該反應的焓變為正值 C.若增大c(A)、c(B),K值增大 D.該反應的化學方程式為:A(g)+B(g)?C(g)+D(g) 組卷:18引用:5難度:0.5 -
7.一定溫度下,難溶電解質在水中達到沉淀溶解平衡時,下列說法錯誤的是( )
A.難溶電解質在水中形成飽和溶液 B.難溶電解質溶解形成的陰、陽離子的濃度一定相等 C.該難溶電解質的Ksp與溫度有關 D.再加入該難溶電解質,溶液中各離子濃度不變 組卷:17引用:2難度:0.5 -
8.南京大學開發出一種以太陽能驅動的恒流電解裝置,成功實現了從海水中提取金屬鋰,其工作原理如圖所示。下列說法錯誤的是( )
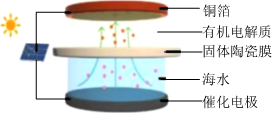
A.銅箔為陰極,發生氧化反應 B.工作時的能量轉化形式:太陽能→電能→化學能 C.陽極區可能有Cl2和CO2生成 D.固體陶瓷膜可讓海水中Li+選擇性通過 組卷:2引用:1難度:0.5
三Ⅱ卷(共52分)
-
25.我們的生活離不開化學,化學物質在不同的領域發揮著重要的作用。根據要求回答下列問題:
(1)工業上可用TiCl4制備納米材料TiO2,用TiCl4制備TiO2?xH2O的化學方程式是。
(2)乙二酸(H2C2O4)俗稱草酸,在實驗研究和化學工業中應用廣泛。25℃時,向10mL 0.1mol?L-1H2C2O4溶液中逐滴加入0.1mol?L-1NaOH溶液,溶液中含碳微粒的物質的量分數隨溶液pH變化如圖所示: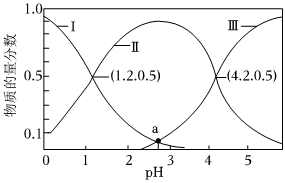
①等濃度的Na2C2O4和NaHC2O4混合溶液顯性(填“酸”“堿”或“中”)并請通過計算說明。25℃時,草酸的電離平衡常數分別是Ka1、Ka2,則=Ka1Ka2。
②a點溶液中,c(Na+)c(C2)+c(HC2O2-4)+c(H2C2O4)(填“>”“=”或“<”),此時溶液的pH=O-4。
(3)①酸性高錳酸鉀應該用滴定管盛裝(填“酸式”或“堿式”)。
②若要測定草酸亞鐵晶體(FeC2O4?xH2O)的x值,步驟如下:稱取0.5400g草酸亞鐵晶體溶于一定濃度的硫酸中,用KMnO4酸性溶液滴定,達到滴定終點時,消耗0.1000mol?L-1的酸性KMnO4溶液18.00mL。則x=。(FeC2O4的摩爾質量是144g?mol-1)組卷:13引用:1難度:0.5 -
26.乙烷裂解制乙烯具有成本低。收率高、投資少、污染小等優點。目前裂解方法有電催化、光催化裂解、直接裂解、氧氣或二氧化碳氧化乙烷裂解等。回答下列問題:
(1)乙烷直接裂解時溫度、壓強及平衡轉化率的關系如圖所示: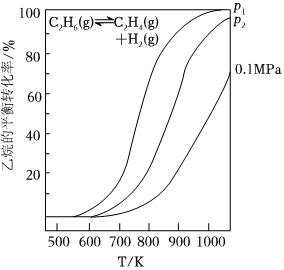
①反應的ΔH0,p1p2(填“>”、“<”或“=”)。
②T℃時,將乙烷與氦氣的混合氣體(乙烷的物質的量分數為m%)通入一密閉容器中發生反應:C2H6(g)?C2H4(g)+H2(g)。平衡時容器內壓強為pKPa,此時乙烷的平衡轉化率為α,則乙烯的平衡分壓為KPa,反應的平衡常數Kp=KPa(分壓=總壓×物質的量分數,計算結果用m、α、p表達)。
(2)已知乙烷直接裂解、CO2氧化裂解和O2氧化裂解反應如下:
(Ⅰ)C2H6(g)?C2H4(g)+H2(g) ΔH1
(Ⅱ)CO2(g)+C2H6(g)?C2H4(g)+CO(g)+H2O(g) ΔH2
(Ⅲ)2C2H6(g)+O2(g)?2C2H4(g)+2H2O(g) ΔH3
①上述反應體系在一定條件下建立平衡后,下列說法正確的有。
A.在反應(Ⅰ)加入催化劑,可降低反應的焓變
B.恒壓摻入Ar能提高反應(Ⅱ)的平衡產率
C.降低溫度,反應(Ⅲ)的正反應速率降低、逆反應速率增大
D.增加乙烷的濃度,反應(Ⅰ)(Ⅱ)(Ⅲ)的平衡均向右移動
②在800℃時發生反應(Ⅲ),乙烷的轉化率、乙烯的選擇性和收率隨投料比的變化關系如圖所示,控制n(C2H6)n(O2)=2,而不采用選擇性更高的n(C2H6)n(O2)=3.5,除可防止積碳外,另一原因是n(C2H6)n(O2);<2時,n(C2H6)n(O2)越小,乙烷的轉化率越大,乙烯的選擇性和收率越小的原因是n(C2H6)n(O2)。(收率=乙烷的轉化率×乙烯的選擇性)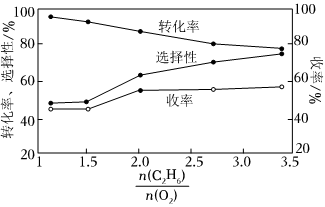 組卷:4引用:1難度:0.6
組卷:4引用:1難度:0.6


