2023-2024學年北京166中高三(上)期中化學試卷
發布:2024/10/2 6:0:2
一、選擇題
-
1.下列有關試劑保存和使用的措施不正確的是( )
A.苯酚不慎滴到手上,用酒精清洗 B.濃HNO3盛放在棕色試劑瓶中,避光保存 C.保存FeSO4溶液時可加入少量鐵粉和稀H2SO4 D.配制1mol/L NaOH溶液時,將稱好的NaOH固體加入容量瓶中溶解 組卷:32引用:4難度:0.5 -
2.下列與事實對應的化學用語正確的是( )
A.Cl的非金屬性強于I:2I-+Cl2═2Cl-+I2 B.C和O形成CO2的過程: 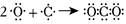
C.0.1mol/L CH3COOH溶液的pH為3:CH3COOH═CH3COO-+H+ D.用石墨電極電解CuCl2溶液:2Cl-+2H+ H2↑+Cl2↑電解組卷:47引用:3難度:0.6 -
3.下列反應的離子方程式書寫正確的是( )
A.用Na2S除去廢水中的Hg2+:S2-+Hg2+═HgS↓ B.用FeCl3溶液刻蝕電路板上的銅:Fe3++Cu═Cu2++Fe2+ C.用過量NaOH溶液脫除煙氣中的SO2:OH-+SO2═HSO3- D.用食醋處理水垢[主要成分CaCO3和Mg(OH)2]:2H++CaCO3═Ca2++CO2↑+H2O 2H++Mg(OH)2═Mg2++2H2O 組卷:29引用:2難度:0.6 -
4.下列說法正確的是( )
A.常溫常壓下,28g乙烯中氫原子的數目約為4×6.02×1023 B.含1mol Na2CO3的溶液中,CO32-的數目約為1×6.02×1023 C.25℃時,pH=11的氨水中,OH-的數目約為0.001×6.02×1023 D.在反應3NO2+H2O═2HNO3+NO中,每生成1mol HNO3轉移的電子數約為2×6.02×1023 組卷:29引用:4難度:0.8 -
5.“神舟十三號”飛船所使用的砷化鎵太陽能電池是我國自主研發、自主生產的產品,擁有全部知識產權。砷(As)和鎵(Ga)都位于第四周期,分別位于第VA族和第ⅢA族。下列說法不正確的是( )
A.原子半徑:Ga>As>P B.熱穩定性:NH3>PH3>AsH3 C.酸性:H3AsO4>H2SO4>H3PO4 D.Ga(OH)3的化學性質可能與Al(OH)3相似 組卷:199引用:5難度:0.7 -
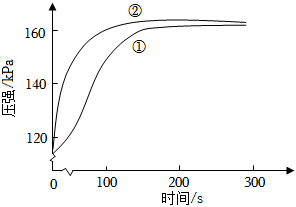 6.在兩個密閉的錐形瓶中,0.05g形狀相同的鎂條(過量)分別與2mL 2mol?L-1的鹽酸和醋酸反應,測得容器內壓強隨時間的變化曲線如圖。下列說法正確的是( )
6.在兩個密閉的錐形瓶中,0.05g形狀相同的鎂條(過量)分別與2mL 2mol?L-1的鹽酸和醋酸反應,測得容器內壓強隨時間的變化曲線如圖。下列說法正確的是( )A.①代表的是鹽酸與鎂條反應時容器內壓強隨時間的變化曲線 B.任意相同時間段內,鹽酸與Mg反應的化學反應速率均快于醋酸與Mg反應的化學反應速率 C.反應中醋酸的電離被促進,兩種溶液最終產生的氫氣總量基本相等 D.1mol?L-1NaOH溶液完全中和上述兩種酸溶液,鹽酸消耗NaOH溶液的體積更大 組卷:80引用:8難度:0.7
二、
-
18.陽離子交換膜法電解飽和食鹽水具有綜合能耗低、環境污染小等優點。生產流程如下圖所示:
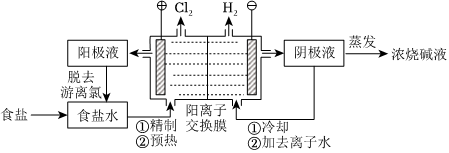
(1)電解飽和食鹽水的化學方程式為。
(2)電解結束后,能夠脫去陽極液中游離氯的試劑或方法是(填字母序號)。
a.Na2SO4 b.Na2SO3c.熱空氣吹出 d.降低陽極區液面上方的氣壓
(3)食鹽水中的I-若進入電解槽,可被電解產生的Cl2氧化為ICl,并進一步轉化為.IO-3可繼續被氧化為高碘酸根(IO-3),與Na+結合生成溶解度較小的NaIO4沉積于陽離子交換膜上,影響膜的壽命。IO-4
①從原子結構的角度解釋ICl中碘元素的化合價為+1價的原因:。
②NaIO3被氧化為NaIO4的化學方程式為。
(4)在酸性條件下加入NaClO溶液,可將食鹽水中的I-轉化為I2,再進一步除去。通過測定體系的吸光度,可以檢測不同pH下I2的生成量隨時間的變化,如圖所示。已知:吸光度越高表明該體系中c(I2)越大。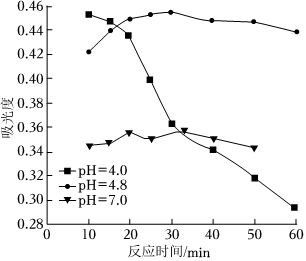
①結合化學用語解釋10 min時不同pH體系吸光度不同的原因:。
②pH=4.0時,體系的吸光度很快達到最大值,之后快速下降。吸光度快速下降的可能原因:。
③研究表明食鹽水中I-含量≤0.2 mg?L-1時對離子交換膜影響可忽略。現將1m3含I-濃度為1.47 mg?L-1 的食鹽水進行處理,為達到使用標準,理論上至少需要0.05mol?L-1 NaClO溶液L.(已知NaClO的反應產物為NaCl,溶液體積變化忽略不計)組卷:105引用:5難度:0.6 -
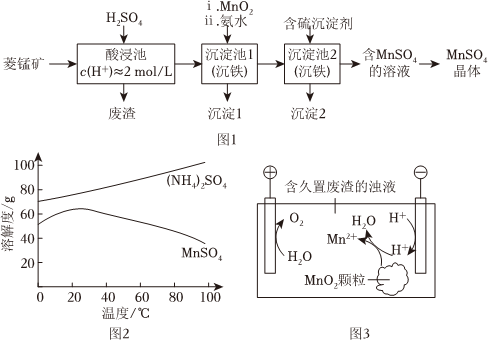
19.MnSO4是一種重要的化工產品。以菱錳礦(主要成分為MnCO3,還含有Fe3O4、FeO、CoO等)為原料制備MnSO4的工藝流程如圖1。
資料:金屬離子沉淀的pH
(1)酸浸后所得溶液的金屬陽離子包括Mn2+、Co2+、金屬離子 Fe3+ Fe2+ Co2+ Mn2+ 開始沉淀 1.5 6.3 7.4 7.6 完全沉淀 2.8 8.3 9.4 10.2 。
(2)沉淀池1中,先加MnO2充分反應后再加氨水。寫出加MnO2時發生反應的離子方程式:。
(3)沉淀池2中,不能用NaOH代替含硫沉淀劑,原因是。
(4)如圖2為MnSO4和(NH4)2SO4的溶解度曲線。從“含MnSO4的溶液”中提取“MnSO4晶體”的操作為,洗滌干燥。
(5)受實際條件限制,“酸浸池”所得的廢渣中還含有錳元素,其含量測定方法如下。
ⅰ.稱取ag廢渣,加酸將錳元素全部溶出成Mn2+,過濾,將濾液定容于100mL容量瓶中;
ⅱ.取25.00mL溶液于錐形瓶中,加入少量催化劑和過量(NH4)2S2O8溶液,加熱、充分反應后,煮沸溶液使過量的(NH4)2S2O8分解。
ⅲ.加入指示劑,用bmol/L(NH4)2Fe(SO4)2溶液滴定。滴定至終點時消耗(NH4)2Fe(SO4)2溶液的體積為cmL,重新變成Mn2+。MnO-4
①補全步驟ⅱ中反應的離子方程式:2Mn2++S2+O2-8催化劑△+MnO-4+。
②廢渣中錳元素的質量分數為。
(6)廢渣長期露置于空氣;其中的錳元素逐漸轉化為MnO2。研究者用圖3裝置提取MnO2中的錳元素。圖3中“H?”代表氫自由基。實驗測得電解時間相同時,隨外加電流的增大,溶液中的c(Mn2+)先增大后減小,減小的原因可能是、。(寫出兩條)組卷:83引用:9難度:0.5


