2020-2021學年上海市行知中學高一(下)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題
-
1.關于硫的敘述正確的是( )
A.硫的非金屬性較強,所以只以化合態存在于自然界 B.分離黑火藥中的硝酸鉀、炭、硫要用到二氧化碳、水以及過濾操作 C.硫與金屬或非金屬反應均作為氧化劑 D.3.2g硫與6.4g 銅反應能得到9.6g 純凈硫化物 組卷:40引用:1難度:0.8 -
2.下列為除去物質中的少量雜質所選試劑不正確的是( )
選項 物質(雜質) 試劑 A CO2(NH3) 濃硫酸 B H2(SO2) 氫氧化鉀溶液 C NO(NO2) 水 D NH3(SO2) 品紅溶液 A.A B.B C.C D.D 組卷:57引用:3難度:0.6 -
3.下列敘述正確的是( )
A.SO2能使品紅溶液褪色,所以它也能使酸堿指示劑褪色 B.濃硫酸在常溫下與鐵不反應,所以可以用鐵罐車運輸濃硫酸 C.濃硫酸使木棒或棉花變黑,體現了濃硫酸的吸水性 D.BaSO4可作“鋇餐”進行X射線檢查 組卷:41引用:2難度:0.6 -
4.除去CO2中混有少量的SO2,最好選用的試劑是( )
A.飽和蘇打溶液 B.品紅溶液 C.氯水 D.飽和小蘇打溶液 組卷:102引用:2難度:0.9 -
5.下列反應中,一定有白色沉淀的是( )
①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀鹽酸;
②將SO2氣體通入CaCl2溶液;
③向H2SO3溶液中通入Cl2,再滴加BaCl2和稀硫酸:
④向H2SO3溶液中加入NaOH溶液后再加入BaCl2溶液A.①③④ B.①④ C.①②③④ D.②③④ 組卷:64引用:1難度:0.6 -
6.下列敘述正確的是( )
①標準狀況下,1molSO2和1molSO3的體積相同;②SO2通入BaCl2溶液中不會有沉淀生成;③SO2有漂白性,而濕潤的氯氣也有漂白性,因此將SO2和Cl2以等物質的量混合后漂白作用更強;④SO2既有氧化性又有還原性;⑤SO2通入Ba(OH)2溶液中有白色沉淀生成,若加入足量的稀硝酸,沉淀將全部溶解.A.①② B.②④⑤ C.②④ D.③⑤ 組卷:17引用:2難度:0.7 -
7.下列氣體中,既可用濃硫酸干燥,又可用固體NaOH干燥的是( )
A.Cl2 B.O2 C.SO2 D.NH3 組卷:194引用:63難度:0.9 -
 8.如圖是硫酸試劑瓶標簽上的部分內容,據此下列說法中,正確的是( )
8.如圖是硫酸試劑瓶標簽上的部分內容,據此下列說法中,正確的是( )A.該硫酸可以用來干燥硫化氫氣體 B.若需200mL 4.6mol?L-1的稀硫酸需取該硫酸50mL進行配制 C.l mol Zn與足量的該硫酸反應產生2gH2 D.若不小心將該硫酸濺到皮膚上,應立即用NaOH 溶液沖洗 組卷:27引用:2難度:0.9
五、實驗題
-
24.利用下列實驗研究鐵與濃硫酸的反應(夾持裝置已略去,氣密性已檢驗)。
(1)實驗Ⅰ中體現了濃硫酸的實驗Ⅰ 實驗Ⅱ 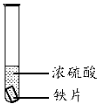
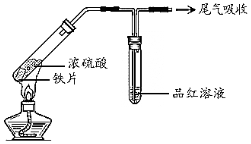
鐵片表面迅速變暗,之后無明顯變化 加熱后產生大量氣體,品紅溶液褪色 (填“氧化性”或“還原性”)。
(2)下列裝置中,能用于實驗Ⅱ中尾氣吸收的是(填序號)。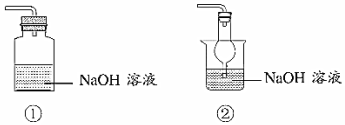
(3)實驗Ⅱ中,能夠證明生成了SO2的證據是。
(4)實驗Ⅰ和Ⅱ中,實驗現象不同的原因是。組卷:66引用:3難度:0.5 -
25.某化學課外興趣小組為探究銅與濃硫酸的反應,用如圖所示的裝置進行實驗:
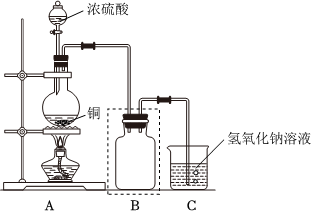
請回答下列問題:
(1)B是用來收集實驗中產生氣體的裝置,但未將導管畫全,請將裝置圖補充完整.
(2)實驗中他們取6.4g銅片和12mL 18mol?L-1濃硫酸放在圓底燒瓶中共熱,直到反應停止,最后發現燒瓶中還有銅片剩余,該小組中的同學認為還有一定量的硫酸剩余.
①寫出銅與濃硫酸反應的化學方程式:;
實驗中若有m g銅參加了反應,則有mol硫酸被還原,電子轉移數目為.
②下列試劑中,能證明反應停止后燒瓶中有硫酸剩余的是(填寫字母編號).
A.硫酸鈉溶液 B.氯化鋇溶液 C.銀粉 D.碳酸鈉溶液
③為什么有一定量的硫酸剩余但未能使銅片完全溶解?你認為的原因是.
(3)為了測定消耗硫酸的物質的量,該興趣小組設計了兩個實驗方案:
方案一:將裝置A產生的氣體緩緩通過已稱量過的裝有堿石灰的干燥管,反應停止后再次稱量,兩次質量差即是吸收的二氧化硫.
方案二:將裝置A產生的氣體緩緩通入足量的用硫酸酸化的高錳酸鉀溶液,再加入足量的氯化鋇溶液,過濾、洗滌、干燥,稱得沉淀的質量即是二氧化硫轉化為硫酸鋇沉淀的質量.
實際上,方案一、二均不可取.
方案一產生的氣體中含有,使干燥管增重偏大;也可能由于,使干燥管增重偏小.
方案二:由于與氯化鋇溶液反應,使測定消耗硫酸的物質的量結果偏大.組卷:171引用:3難度:0.1


