2020-2021學年福建省泉州市培元中學高二(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意;每小題4分,共40分)
-
1.“中國芯”的主要原材料是高純單晶硅,反應SiCl4(g)+2H2(g)
Si(S)+4HCl(g)可用于純硅的制備。下列有關說法正確的是( )高溫A.SiCl4為極性分子 B.HCl的電子式為 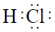
C.單晶硅為分子晶體 D.Si原子的結構示意圖為 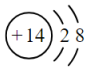 組卷:99引用:7難度:0.6
組卷:99引用:7難度:0.6 -
2.下列說法中,正確的是( )
A.冰融化時,分子中H-O鍵發生斷裂 B.金屬晶體的熔、沸點一定比分子晶體的高 C.原子晶體中,共價鍵的鍵長越短,鍵能越大,熔點就越高 D.分子晶體中,分子間作用力越大,則分子越穩定 組卷:70引用:3難度:0.5 -
3.下列說法正確的是( )
A.含有陰離子的晶體一定含有陽離子 B.H2O的熱穩定性比H2S強,是由于H2O的分子間存在氫鍵 C.HF溶于水時只破壞了分子間作用力 D.NaHSO4屬于離子晶體,熔融時破壞離子鍵和共價鍵 組卷:14引用:2難度:0.7 -
4.在以離子鍵為主的化學鍵中常含有共價鍵的成分。下列各對原子形成化學鍵中共價鍵成分最少的是( )
A.Li,F B.Na,F C.Na,Cl D.Mg,O 組卷:566引用:32難度:0.9 -
5.氫鍵的本質是缺電子的氫原子和富電子的原子或原子團之間的一種弱的電性作用。近年來,人們發現了雙氫鍵,雙氫鍵是指帶正電的H原子與帶負電的H原子之間的一種弱電性相互作用。下列不可能形成雙氫鍵的是( )
A.Be-H...H-O B.K-H...H-N C.O-H...H-N D.F-H...H-Al 組卷:57引用:2難度:0.8
二、非選擇題(共60分)
-
 14.金屬及其相關化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
14.金屬及其相關化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
(1)下列關于金屬及金屬鍵的說法不正確的是。(填字母代號)
a.金屬鍵沒有方向性與飽和性
b.金屬鍵是金屬原子與自由電子間的相互作用
c.金屬熔沸點不同的原因可以用金屬鍵強弱解釋
d.電子氣理論可解釋金屬材料的延展性,不能解釋金屬有良好的導電性
(2)釩廣泛用于催化及鋼鐵工業,基態釩原子的價層電子排布圖為。
(3)二茂鐵又叫雙環戊二烯基鐵[Fe(C5H5)2],熔點是172.5~173℃,100℃以上升華,二茂鐵屬于晶體。已知分子中的大π鍵可用符號表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為πnm)。已知二茂鐵的每個茂環帶有一個單位負電荷,則每個環中的大π鍵應表示為π66。
(4)銅可以形成一種離子化合物[Cu(NH3)4(H2O)2]SO4,若要確定[Cu(NH3)4(H2O)2]SO4是晶體還是非晶體,最科學的方法是對其進行實驗,其中陰離子的空間構型是,該化合物加熱時首先失去的組分是H2O,原因是。
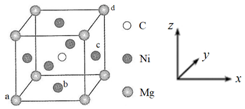
(5)最近發現,只含鎂、鎳和碳三種元素的晶體也具有超導性,該物質形成的晶體的立方晶胞結構如圖所示。
①與Mg緊鄰的Ni有個。
②原子坐標參數可表示晶胞內部各原子的相對位置。該晶胞中原子的坐標參數為a為(0,0,0);b為(,12,0);d為(1,1,1)。則c原子的坐標參數為12。
③若晶胞中Ni、Mg之間的最短距離為a pm,阿伏加德羅常數的值為NA,則晶體的密度ρ=g?cm-3(用含a、NA的代數式表示)。組卷:42引用:7難度:0.6 -
15.磷酸鐵鋰電池是綠色環保型電池,電池的總反應為:Li1-xFePO4+LixC6═LiFePO4+C6。
(1)LiFePO4中Fe2+的核外電子排布式為,該電池反應物中所涉及第二周期元素的第一電離能由大到小的順序是(用元素符號表示)。
(2)H3PO4和H2CO3中P和C原子的雜化方式(填“相同”或“不相同”)。
(3)石墨可用作鋰離子電池的負極材料,Li+嵌入石墨的兩層間,導致石墨的層堆積方式發生改變,形成化學式為LixC6的嵌入化合物,某石墨嵌入化合物的平面結構如圖1所示,則x=;若每個六元環都對應一個Li+,則化學式為。
(4)碳的另一種同素異形體——金剛石,其晶胞如圖2所示。已知金屬鈉的晶胞(體心立方堆積)沿其體對角線垂直在紙平面上的投影圖如圖3A所示,則金剛石晶胞沿其體對角線垂直在紙平面上的投影圖應該是圖3的(從A~D圖中選填)。
(5)某金屬鋰的硼氫化物是優質固體電解質,并具有高儲氫密度。陽離子為Li+,陰離子是由12個硼原子和12個氫原子所構成的離子團。陰離子在晶胞中位置如圖4所示,其堆積方式為,Li+占據陰離子組成的所有正四面體空隙中心,該化合物的化學式為(用最簡整數比表示)。假設晶胞邊長為anm,則兩個最近的Li+的距離為nm。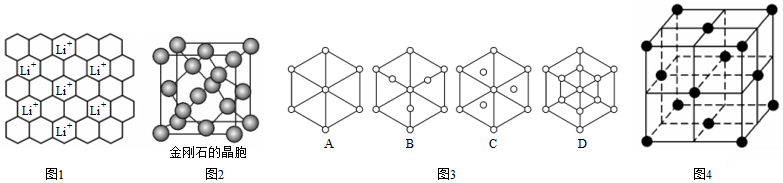 組卷:22引用:1難度:0.6
組卷:22引用:1難度:0.6


