2021-2022學(xué)年重慶八中高二(上)第一次月考化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題僅有一個正確選項(xiàng),共14小題,每題3分)
-
1.化學(xué)與社會、生產(chǎn)、生活密切相關(guān),下列說法錯誤的是( )
A.廢舊鋼材焊接前,可用飽和NH4Cl溶液處理焊點(diǎn)的鐵銹 B.生活中常用明礬凈水,可加速水中懸浮物沉降 C.將草木灰與NH4Cl混合施用,可更好為植物全面提供N、K兩種營養(yǎng)元素 D.加熱純堿溶液可以增強(qiáng)其去油污的能力 組卷:10引用:3難度:0.6 -
2.下列事實(shí)能說明醋酸是弱電解質(zhì)的是( )
①醋酸與水能以任意比互溶
②常溫下0.1mol/L醋酸鈉溶液的pH=8.9
③醋酸溶液中存在醋酸分子
④0.1mol/L醋酸的pH比0.1mol/L鹽酸的pH大
⑤醋酸溶液能導(dǎo)電A.①⑤ B.②③④ C.③④⑤ D.①② 組卷:8引用:2難度:0.7 -
3.在25℃條件下,將pH=4的NH4Cl溶液加水稀釋過程中,下列說法正確的是( )
A.能使NH4Cl的水解常數(shù)Kh增大 B.溶液中c(H+)?c(OH-)不變 C.能使溶液中n(NH4+)增大 D.此過程中,溶液中所有離子濃度均減小 組卷:236引用:2難度:0.7 -
4.下列事實(shí)能用勒夏特列原理解釋的是( )
A.工業(yè)合成氨選擇500℃ B.SO2氧化成SO3,需要使用催化劑 C.光照新制氯水時,溶液的顏色逐漸變淺 D.由NO2(g)和N2O4(g)組成的平衡體系,加壓后顏色加深 組卷:20引用:6難度:0.7 -
5.下列方程式正確的是( )
A.CH3COONH4的電離:CH3COONH4?NH4++CH3COO- B.HSO3-的水解:HSO3-+H2O?H3O++SO32- C.AlCl3的電離:AlCl3═Al3++3Cl- D.向硫酸鋁溶液中滴加碳酸鈉溶液:2Al3++3CO32-═Al2(CO3)3↓ 組卷:4引用:2難度:0.6 -
6.常溫下,下列溶液中各組離子一定能大量共存的是( )
A.由水電離產(chǎn)生的c(H+)=10-12mol/L的溶液:K+、SO42-、CO32-、Cl- B. =0.1mol/L的溶液:Na+、K+、CO32-、NO3-Kwc(H+)C.pH=7的溶液中,Na+、Fe3+、CO32-、Cl- D.含有S2-的溶液:Cu2+、H+、MnO4-、SO42- 組卷:4引用:1難度:0.7
二、填空題(共5小題,共58分)
-
18.習(xí)近平主席在《中央城鎮(zhèn)化工作會議》發(fā)出號召:“讓居民望得見山、看得見水、記得住鄉(xiāng)愁”。消除含氮、硫、氯等化合物對大氣和水體的污染對建設(shè)美麗家鄉(xiāng),打造宜居環(huán)境具有重要意義。
(1)以HCl為原料,用O2氧化制取Cl2,可提高效益,減少污染。反應(yīng)為:4HCl(g)+O2(g)2Cl2(g)+2H2O(g)ΔH=-115.4kJ?mol-1,通過控制合適條件,分兩步循環(huán)進(jìn)行,可使HCl轉(zhuǎn)化率接近100%。原理如圖1所示:CuO/CuCl2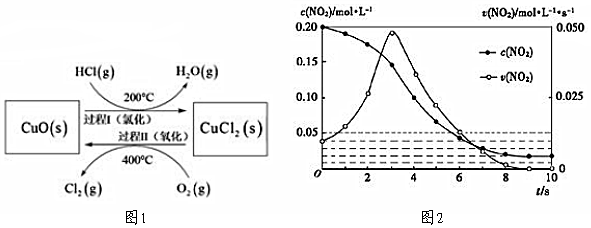
過程Ⅰ的反應(yīng)為:2HCl(g)+CuO(s)CuCl2(s)+H2O(g)ΔH1=-120.4kJ?mol-1,過程Ⅱ反應(yīng)的熱化學(xué)方程式為200℃。
(2)容積均為1L的甲、乙兩個容器,其中甲為絕熱容器,乙為恒溫容器。相同溫度下,分別充入0.2mol的NO2,發(fā)生反應(yīng):2NO2(g)?N2O4(g)ΔH<0,甲中NO2的相關(guān)量隨時間變化如圖2所示。
①0~3s內(nèi),甲容器中NO2的反應(yīng)速率增大的原因是。
②甲達(dá)平衡時,溫度若為T℃,此溫度下的平衡常數(shù)K=。
③平衡時,K甲K乙,P甲P乙(填“>”、“<”或“=”)。
(3)工業(yè)上可用Na2SO3溶液吸收法處理SO2,25℃時用1mol?L-1的Na2SO3溶液吸收SO2,當(dāng)溶液pH=7時,溶液中各離子濃度的大小關(guān)系為。(已知25℃時:H2SO3的電離常數(shù)Ka1=1.3×10-2,Ka2=6.2×10-8)組卷:7引用:1難度:0.7 -
19.磷的含氧酸有次磷酸(H3PO2)、亞磷酸(H3PO3)、磷酸(H3PO4)等多種,它們都是重要的化工原料。
(1)已知次磷酸(H3PO2)的水溶液中存在H3PO2分子,H3PO2與足量NaOH溶液充分反應(yīng),消耗的酸和堿的物質(zhì)的量相等,反應(yīng)的離子方程式為,生成的鹽屬于(填“正鹽”或“酸式鹽”)。
(2)查閱資料知25℃時,亞磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。25℃時,Na2HPO3水解反應(yīng)的Kh=(填數(shù)值);向H3PO3溶液中滴加NaOH溶液,恰好完全反應(yīng)時所得溶液的pH7(填“>”、“<”或“=”,下同);若用甲基橙做指示劑,用NaOH溶液滴定,達(dá)到滴定終點(diǎn)時所得溶液的c(Na+)c(H2PO3-)+2c(HPO32-)。
(3)磷酸(H3PO4)在水溶液中各種微粒的物質(zhì)的量分?jǐn)?shù)δ隨pH的變化曲線如圖所示: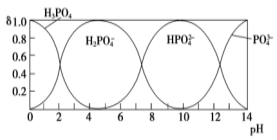
①向某濃度的磷酸溶液中滴加NaOH溶液,以酚酞為指示劑,當(dāng)溶液由無色變?yōu)闇\紅色時,發(fā)生的主要反應(yīng)的離子方程式是。
②25℃條件下測得0.1mol/L的Na3PO4溶液的pH=12,則Na3PO4的第一步水解的水解常數(shù)Kh=(忽略Na3PO4的第二、第三步水解,結(jié)果保留兩位有效數(shù)字)。
③從圖中推斷NaH2PO4溶液中各種微粒濃度大小關(guān)系正確的是。(填字母)
A.c(Na+)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H+)+c(Na+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)組卷:24引用:1難度:0.7


