魯科版(2019)選擇性必修1《2.4 化學反應條件的優化-工業合成氨》2021年同步練習卷(3)
發布:2024/10/27 1:30:2
一、單選題
-
1.如下反應條件的控制中,不恰當的是( )
A.為防止鐵生銹,在其表面涂一層防銹油漆 B.為防止火災,在面粉廠、加油站等場所要嚴禁煙火 C.為加快KClO3的分解速率而加入MnO2 D.降溫加快H2O2的分解速率 組卷:51引用:10難度:0.8 -
2.如圖為工業合成氨的流程圖。圖中為提高原料轉化率前采取的措施是( )

A.①②③ B.①③⑤ C.②④⑤ D.②③④ 組卷:110引用:10難度:0.8 -
3.下列說法不正確的是( )
A.將純鐵片放入稀硫酸中,反應緩慢,再加入少量硫酸銅溶液,可加快產生氫氣的速率 B.稀鹽酸跟鋅片反應,加入少量的氯化鈉固體,反應速率不變 C.反應2H2O2═2H2O+O2↑,加入MnO2或升高溫度都能加快O2的生成速率 D.用鐵片和稀硫酸反應制取氫氣時,改用98%的硫酸可加快產生氫氣的速率 組卷:66引用:4難度:0.5 -
4.下列關于化學反應速率和化學平衡的說法正確的是( )
A.反應物之間同時存在多個反應時,理想的催化劑可以提高目標產物在最終產物中的比率 B.化學平衡正向移動,反應物的轉化率一定提高 C.增大壓強,化學反應速率一定增大 D.溫度對可逆反應中放熱反應速率的影響程度大于吸熱反應 組卷:14引用:2難度:0.5 -
5.2SO2(g)+O2(g)=2SO3(g)△H=-198kJ?mol-1,在V2O5存在時,該反應機理為:V2O5+SO2→+2VO2+SO3(快) 4VO2+O2→2V2O5(慢)下列說法正確的是( )
A.反應速率主要取決于V2O5的質量 B.VO2是該反應的催化劑 C.該反應逆反應的活化能大于198kJ/mol D.升高溫度,該反應的△H增大 組卷:641引用:8難度:0.9 -
6.接觸法制硫酸,接觸室中反應為:2SO2+O2?2SO3,對該反應有關說法錯誤的是( )
A.增大氧氣的濃度能加快反應速率 B.反應中SO2能全部轉化為SO3 C.催化劑能加快該反應的速率 D.升高溫度能加快該反應的速率 組卷:6引用:1難度:0.5 -
7.在密閉容器中進行如下反應:2NO(g)+2CO(g)?N2(g)+2CO2(g)。已知該反應為放熱反應,達到平衡后,為提高該反應速率和NO的轉化率,采取的正確措施是( )
A.加催化劑 B.升高溫度 C.增大壓強 D.向容器中通入NO 組卷:33引用:3難度:0.5
四、實驗題
-
 21.化學是一門以實驗為基礎的學科,弄清實驗原理和細致觀察實驗現象是一種重要的能力。
21.化學是一門以實驗為基礎的學科,弄清實驗原理和細致觀察實驗現象是一種重要的能力。
Ⅰ.某同學利用1mol/LKI溶液、0.1mol/LH2SO4溶液和淀粉溶液探究化學反應速率與溫度的關系。
(1)用離子方程式解釋實驗原理。
(2)在本實驗中需要觀察的實驗現象是。
(3)實驗時,試劑加入順序為①KI溶液、②淀粉溶液、③稀H2SO4溶液,試解釋②③的順序為何不能顛倒。
Ⅱ.某化學小組發現草酸(H2C2O4)溶液與酸性KMnO4溶液反應時,溶液褪色總是先慢后快,為了探究其主要原因,進行了如下實驗:
【實驗原理】5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O【探究記錄及分析】
(1)該實驗采用了單一變量法,其中,實驗①④對比是為了探究K+是否對反應速率有影響,實驗①②對比是為了實驗編號 燒杯中所加試劑及用量mL 控制條件 溶液褪色時間(s)
0.10mol/LH2C2O4溶液等濃度KMnO4
溶液H2O 0.50mol/L稀硫酸 30 20 30 20 18 30 20 30 20 溫度65℃ 13 30 20 30 20 少量MnSO4固體 3.6 30 20 x 20 mL溶液 18 。
(2)x=。
(3)(填“能”、“不能”)用MnCl2固體代替MnSO4固體。
【探究結論】
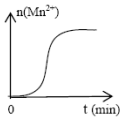
(4)該小組同學根據經驗繪制了n(Mn2+)隨時間變化趨勢的示意圖,如圖1所示。但隨后查閱已有的文獻資料發現,該實驗過程中n(Mn2+)隨時間變化的趨勢應如圖2所示。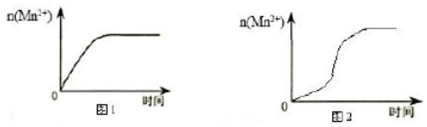
結合文獻資料與實驗得出:草酸(H2C2O4)溶液與酸性KMnO4溶液反應時,溶液褪色先慢后快的主要原因是。組卷:1引用:1難度:0.6
五、簡答題
-
 22.在一定條件下,發生反應:2SO2(g)+O2(g)?2SO3(g)。
22.在一定條件下,發生反應:2SO2(g)+O2(g)?2SO3(g)。
(1)在定溫定容條件下,往密閉容器中充入氦氣(不參與反應),化學反應速率(填“增大”、“減小”或“不變”)。
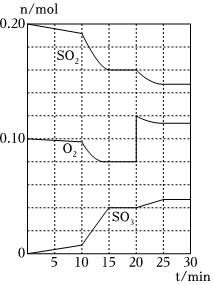
(2)600℃時,在一容積為2 L的密閉容器中,將二氧化硫和氧氣混合,在反應進行至10min 和20min時,分別改變了影響反應的一個條件,反應過程中SO2、O2、SO3物質的量變化如圖所 示,前10min正反應速率逐漸(填“增大”“減小”或“不變”);前15min 內用SO2表示的平均反應速率為。
(3)圖中反應進程,表示正反應速率與逆反應速率相等的時間段是。
(4)根據如圖判斷,10min時改變的條件可能是(填寫編號,下同);20min時 改變的反應條件可能是。
a.加入催化劑
b.縮小容器容積
c.降低溫度
d.增加O2的物質的量組卷:34引用:5難度:0.5


