2020-2021學年吉林省長春外國語學校高二(上)開學化學試卷
發布:2024/12/15 6:0:2
一、選擇題(共7小題,每小題6分,滿分42分)
-
1.下列事實不能作為實驗判斷依據的是( )
A.鈉和鎂分別與冷水反應,判斷金屬活動性強弱 B.鐵投入CuSO4溶液中,能置換出銅,鈉投入CuSO4溶液中不能置換出銅,判斷鈉與鐵的金屬活動性強弱 C.酸性H2CO3<H2SO4,判斷硫與碳的非金屬性強弱 D.F2與Cl2分別與H2反應,判斷氟與氯的非金屬性強弱 組卷:209引用:11難度:0.7 -
2.可以說明硫元素的非金屬性比氯元素的非金屬性弱的是( )
①HCl的溶解度比H2S的大;②HClO的氧化性比H2SO4的強;③HClO4的酸性比H2SO4的強;④HCl比H2S穩定;⑤氯原子最外層有7個電子,硫原子最外層有6個電子;⑥Cl2能與鐵反應生成FeCl3,硫與鐵反應生成FeS;⑦Cl2可以從H2S溶液中置換出S;⑧同濃度的HCl和H2S的水溶液,前者酸性強;⑨HCl(或Cl-)還原性比H2S(或S2-)弱。A.③④⑤⑥⑦⑨ B.③④⑥⑦⑧ C.①②⑤⑥⑦⑨ D.③④⑥⑦⑨ 組卷:110引用:1難度:0.5 -
3.固體A的化學式為NH5,它的所有原子的最外電子層結構都符合相應稀有氣體的最外電子層結構,則下列有關說法不正確的是( )
A.1 mol NH5中含有5NA個N-H鍵(NA表示阿伏加德羅常數的數值) B.NH5中既有共價鍵又有離子鍵 C.NH5的電子式為 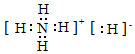
D.NH5與水反應的離子方程式為NH4++H-+H2O═NH3?H2O+H2↑ 組卷:42引用:8難度:0.7 -
4.用CH4催化還原NOx可以消除氮氧化合物的污染.例如:下列說法中錯誤的是( )
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol.A.等物質的量的CH4在反應①、②中轉移電子數相同 B.由反應①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol C.4NO2(g)+2N2(g)=8NO(g);△H=+586kJ/mol D.若用標準狀況下4.48L CH4把NO2還原為N2,整個過程中轉移的電子總數為1.6NA 組卷:479引用:20難度:0.9
二、填空題(共6小題,每小題10分,滿分58分)
-
12.下列反應在210℃達到平衡:
①PCl5(g)?PCl3(g)+Cl2(g)△H>0,K=1;
②CO(g)+Cl2(g)?COCl2(g)△H<0,K=5×104;
③COCl2(g)?CO(g)+Cl2(g);
(1)根據反應①的平衡常數K表達式,下列等式必定成立的是。反應②和反應③的平衡常數K表達式。(填“相同”或“不同”)
A.c(PCl5)=c(PCl3)=c(Cl2)=1
B.c(PCl5)=c(PCl3)c(Cl2)=1
C.c(PCl5)=c(PCl3)c(Cl2)
(2)降低Cl2的濃度,反應③的K值。(填“增大”、“減小”或“不變”)
(3)要使反應①和反應②的K值相等,應采取的措施是。
A.反應①②同時升溫
B.反應①②同時降溫
C.反應①降溫,反應②維持在210℃組卷:9引用:1難度:0.5 -
13.在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)?CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如表:
回答下列問題:t/℃ 700 800 830 1 000 1 200 K 0.6 0.9 1.0 1.7 2.6
(1)該反應的化學平衡常數表達式為K=.
(2)從表中看出,升高溫度,K值,則CO2的轉化率,化學反應速率.(以上均填“增大”“減小”或“不變”)
(3)能判斷該反應是否達到化學平衡狀態的依據是
A.容器中壓強不變
B.混合氣體中c(CO)不變
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某溫度下,平衡濃度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),試判斷此時的溫度為℃.組卷:9引用:2難度:0.3


