2020-2021學年江蘇省蘇州市姑蘇區振華中學九年級(上)期中化學試卷
發布:2025/1/3 0:30:2
一、選擇題’(本題包括20小題,每小題2分,共40分,每小題只有一個正確答案)
-
1.前者為化學變化,后者是物理變化的是( )
A.鐵生銹 石灰水在空氣中變渾濁 B.車胎爆炸 油庫爆炸 C.光合作用 干冰用于人工降雨 D.呼吸作用 工業煉鐵 組卷:4引用:1難度:0.8 -
2.燃著的火柴梗豎直向上,火柴梗不易繼續燃燒,其原因是( )
A.火柴梗溫度達不到著火點 B.火柴梗著火點高 C.火柴梗著火點低 D.火柴梗接觸氧氣少 組卷:55引用:14難度:0.9 -
3.下列產品的開發利用與環境保護無關的是( )
A.無磷洗衣粉 B.加碘食鹽 C.無鉛汽油 D.無氟冰箱 組卷:59引用:101難度:0.7 -
4.將3克碳放在5克氧氣中燃燒后得到的氣體是( )
A.CO B.CO2 C.CO2和O2 D.CO和CO2 組卷:13引用:1難度:0.9 -
5.下列五種物質所含氯元素的化合價按一定順序排列:①NaCl、②Cl2、③HClO、④X、⑤HClO3根據這種排列規律,X可能是( )
A.KCl B.ClO2 C.NaClO4 D.KClO3 組卷:54引用:6難度:0.7 -
6.為防止食品腐爛變質,在食品包裝袋中充入的氣體物質最好是( )
A.氮氣 B.氧氣 C.二氧化碳 D.二氧化硫 組卷:5引用:3難度:0.9 -
7.在一定條件下,下列轉化不能由一步反應實現的是( )
A.H2O→O2 B.H2→H2CO3 C.O2→CO D.KMnO4→K2MnO4 組卷:18引用:1難度:0.9 -
8.可一次鑒別出氧氣、空氣、二氧化碳三瓶氣體的方法是( )
A.將帶火星的木條伸入瓶中 B.將燃著的木條放在瓶口 C.將燃著的木條伸入瓶中 D.加入澄清石灰水 組卷:7引用:1難度:0.6 -
9.下列反應中,既是化合反應又是氧化反應的是( )
A.CH4+2O2 CO2+2H2O點燃B.CO2+Ca(OH)2=CaCO3↓+H2O C.3Fe+2O2 Fe3O4點燃D.Cu2(OH)2CO3 2CuO+CO2↑+H2O加熱組卷:10引用:1難度:0.6
二、非選擇題
-
26.善于提出問題、探究問題和解決問題是學好化學的重要方法,某研究性學習小組的同學在學習鐵及其化合物知識時進行了系列研究.
【提出問題】
問題1:鐵為何稱為黑色金屬?
問題2:鐵和氧氣在不同條件下能發生哪些反應?
問題3:鐵有多種氧化物,它們的性質有哪些差異?
問題4:鋼鐵廠在選礦時,如何測定鐵礦石中的含鐵量?
問題5:用一氧化碳還原氧化鐵得到的黑色固體一定是單質鐵嗎?
Ⅱ.解決問題
【問題1】上網查尋,有兩種說法
a.因為在鐵表面有黑色的鐵的氧化物,所以叫黑色金屬
b.因為鐵的粉末為黑色,鐵的氧化物也均為黑色,所以叫黑色金屬
(1)你認為正確的說法是(填“a”或“b”)
【問題2】通過學習,已經知道鐵絲在潮濕的空氣中能生銹,也能在純氧中燃燒.
(2)請寫出一種防止鋼鐵生銹的方法;
(3)請寫出鐵絲在純氧中燃燒的化學方程式.
【問題3】查閱資料:a.鐵常見的氧化物有氧化鐵(Fe2O3)、四氧化三鐵(Fe3O4)和氧化亞鐵(FeO).
b.四氧化三鐵是具有磁性的黑色晶體,可以近似地看作是氧化亞鐵和氧化鐵的化合物.它不溶于水,能與酸反應生成兩種鹽.
c.氧化亞鐵是不溶于水的黑色粉末,能與酸反應,無磁性,也不能被磁鐵吸引.
(4)請寫出四氧化三鐵與鹽酸反應的化學方程式.
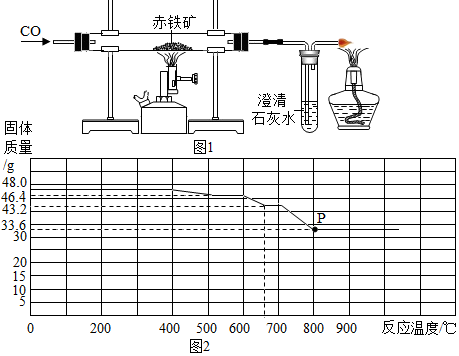
【問題4】同學們參觀了某鋼鐵廠,了解到鋼鐵廠在選礦時測定鐵礦石中含鐵量的方法較多,小明結合所學知識,設計了如圖1所示的實驗裝置測定某赤鐵礦樣品中Fe2O3的質量分數.他稱取l0.0g赤鐵礦,當赤鐵礦中的Fe2O3全部還原為Fe時,剩余固體在CO的保護下冷卻、稱量.質量為7.6g(假設赤鐵礦中的雜質均不與CO反應)
(5)圖中酒精燈的作用是.
(6)該赤鐵礦中Fe2O3的質量分數為(列出計算過程).
【問題5】在鋼鐵廠的實驗室.同學們采集了用某種熱分析儀記錄的C0與Fe2O3進行反應時的有關數據,并得到固體質量與反應溫度的關系曲線.如圖2所示.
(7)根據圖象分析,寫出P點時固體成分的化學式.固體質量由48.0g變為46.4g的過程中發生反應的化學方程式為.組卷:65引用:2難度:0.1 -
27.化學興趣小組測定某石灰石樣品中碳酸鈣的質量分數。(假定:石灰石樣品中除碳酸鈣外,其余物質不與稀鹽酸反應也不溶于水)
Ⅰ.他們的方法是:
①取3.0g樣品放入燒杯;
②加入足量的稀鹽酸至恰好不再產生氣體時,測定反應后生成的CO2質量;
③根據CO2的質量求出樣品中碳酸鈣的質量及質量分數。
Ⅱ.為測定CO2的質量,他們想出了以下方案,請幫助他們完成設計方案:
(1)選用如圖(填“甲”或“乙”)裝置可測量產生的CO2的,再利用此時CO2的密度,可計算CO2的質量。圖中瓶內水面上油層的作用是。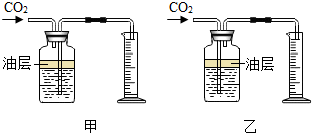
(2)他們選用該方案時測量的氣體在常溫下體積為440mL。已知常溫下CO2氣體的密度為2.0g/L,則上述反應放出氣體的質量為g。
Ⅲ.實驗后小明提出用不同的方法測定CO2的質量,從而測定石灰石樣品中碳酸鈣的質量分數。小明取6.0g樣品放入燒杯(燒杯質量為10.0g)中,將50.0g稀鹽酸分5次加入,并對燒杯進行了稱量,記錄如下:
(1)該實驗中6.0g樣品與反應時間 t1 t2 t3 t4 t5 加入稀鹽酸的總質量/g 10 20 30 40 50 燒杯和藥品的質量/g 25.56 35.12 44.68 54.24 64.24 g稀鹽酸恰好完全反應。
(2)充分反應后生成二氧化碳的質量為g。
(3)石灰石樣品中碳酸鈣的質量分數是(結果精確到0.1%)。
(4)所加稀鹽酸中氯化氫的質量分數是(結果精確到0.1%)。
Ⅳ.小亮說除了上述實驗方法外,他還能用不同的方法測定樣品中碳酸鈣的質量分數:
(1)取mg樣品放入燒杯;
(2)加入足量的稀鹽酸至不再產生氣體時,過濾,洗滌、干燥后稱量剩余固體質量為ng;
(3)根據剩余固體的質量求出樣品中碳酸鈣的質量分數為。(用m、n的代數式表示)組卷:46引用:1難度:0.5


