2021-2022學年福建省莆田市高三(上)第一次質檢化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題4分,共40分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.福建擁有眾多非物質文化遺產,如剪紙(浦城剪紙)、武夷巖茶(大紅袍)制作技藝、德化白瓷燒制技藝、安溪藍印花布等,下列說法錯誤的是( )
A.浦城剪紙的剪裁過程中不涉及化學變化 B.沖泡武夷巖茶時,茶香四溢,體現了分子的無規則運動 C.德化白瓷中含大量的二氧化硅、氧化鉀和三氧化二鐵 D.安溪藍印花布所用染料靛藍素屬于有機化合物 組卷:6引用:1難度:0.7 -
2.《本草綱目》“燒酒”寫道:“自元時始創其法,用濃酒和糟入甑,蒸令氣上…其清如水,味極濃烈,蓋酒露也”。若在實驗室里完成文中操作,不需要的儀器是( )
A. 
B. 
C. 
D.  組卷:84引用:10難度:0.7
組卷:84引用:10難度:0.7 -
3.下列對科技新成果的解讀錯誤的是( )
科技成就 化學解讀 A 《科學)公布了下地幔礦物一毛河光礦(MgFe2O4 )的命名 MgFe2O4中鐵元素顯+2價 B 我國利用雙核催化劑實現乙烯和丙烯醇低溫共聚 乙烯和丙烯醇是共聚物的單體 C 我國成功研制出Zn5(OH)8(NO3)2?2H2O納米片 它屬于堿式鹽 D 我國利用葡萄糖脫氫酶除去廢水中葡萄糖 酶對某些特定反應有催化作用 A.A B.B C.C D.D 組卷:9引用:3難度:0.7 -
4.某溶液中含有如表中的五種離子,且陽離子濃度均為0.5mol?L-1,陰離子濃度均為1mol?L-1,下列有關該溶液的離子組合正確的是( )
陽離子 Fe3+、K+、Al3+、NH4+、Na+、Mg2+、H+ 陰離子 Cl-、SO42-、I-、CO32-、NO3-、OH- A.Al3+、Fe3+、Cl-、NO3-、I- B.Na+、K+、Cl-、SO42-、OH- C.Na+、NH4+、H+、K+、CO32- D.Na+、Mg2+、NH4+、Cl-、NO3- 組卷:18引用:2難度:0.9 -
5.我國科學家在天然藥物活性成分研究方面取得進展。例如:
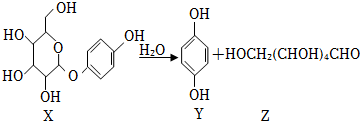
下列說法正確的是( )A.X和Y的苯環上的一氯代物均只有1種 B.X、Z都能發生酯化反應 C.Z和HOCH2CHO互為同系物 D.用鈉可以區別X和Z 組卷:5引用:2難度:0.5
二、非選擇題:本題共5小題,共60分。
-
14.我國科學家合成高選擇性光催化劑,在溫和條件下利用CO2合成CH3CHO:
反應1:2CO2(g)+5H2(g)?CH3CHO(g)+3H2O(g)△H1=-170kJ?mol-1
反應2:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H2=-178kJ?mol-1
回答下列問題:
(1)2CH4(g)+H2(g)?CH3CHO(g)+3H2(g)ΔH=kJ?mol-1。
(2)一定溫度下,在剛性密閉容器中充入一定量CO2和H2,發生反應1。
①下列情況表明該反應達到平衡狀態的是(填標號)。
A.混合氣體密度保持不變
B.CO2(g)消耗速率和H2O(g)生成速率之比為2:3
C.CH3CHO(g)、H2O(g)的濃度之比保持不變
D.混合氣體平均摩爾質量保持不變
②達到平衡之后,其他條件不變僅改變下列一個條件,能提高CO2的平衡轉化率的是(填標號)。
A.增大CO2濃度
B.充入惰性氣體
C.降低溫度
D.加入高效催化劑
(3)已知:反應2CO2(g)+5H2(g)?CH3CHO(g)+3H2O(g)生成CH3CHO的凈反應速率為v凈=k正c2(CO2)?c5(H2)-k逆c(CH3CHO)?c3(H2O)(k正、k逆分別表示正、逆反應速率常數,只與溫度、催化劑有關,與濃度無關)。該反應的平衡常數K與k正、k逆的關系式為。k正、k逆的負對數用pk表示,與溫度(T)關系如圖1所示。其中代表pk正與T關系的直線是(填標號),判斷理由是。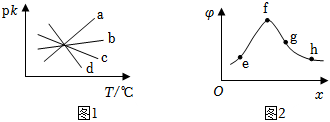
(4)一定溫度下,在剛性密閉容器中充入1molCO2(g)和xmolH2(g),僅發生反應1,測得平衡體系中CH3CHO的體積分數(φ)與x關系如圖2所示。在e、f、g、h4點中,CH3CHO產率最高的是(填字母),f點對應體系中H、O原子個數比接近。
(5)一定溫度下,在剛性密閉容器中充入2molCO2和5molH2,發生反應1和2,達到平衡時測得CH3CHO的選擇性為80%,CO2的平衡轉化率為45%,總壓強為560kPa。反應1的平衡常數Kp=(只列計算式,不帶單位)。[已知:CH3CHO的選擇性=×100%分的分壓計算的平衡常數為Kp,分壓=總壓×物質的量分數]n(CH3CHO)n(CH3CHO)+n(CH4)組卷:77引用:7難度:0.4 -
15.某化學興趣小組進行了實驗:向2支試管中分別加入0.5gNa2CO3固體和0.5gNaHCO3固體,再分別加入30mL0.3mol?L-1鹽酸,充分反應后,用手觸摸試管,明顯感覺到加Na2CO3固體的試管變熱了,加NaHCO3固體的試管變冷了。甲同學由此得出結論:CO32-(aq)+2H+(aq)=H2O(1)+CO2(g)△H1<0,HCO3-(aq)+H+(aq)=H2O(1)+CO2(g)△H2>0。
回答下列問題:
(1)乙同學認為該實驗不一定能得到甲同學的結論,你支持誰的觀點?(填“甲”或“乙”),理由是。
(2)查閱資料:
反應I:CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)△H1=-12.14kJ?mol-1;
反應II:HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H2=+12.64kJ?mol-1。
向VmLcmol?L-1碳酸鈉溶液中,逐滴加入2VmLcmol?L-1稀鹽酸。下列圖像中,能正確表示該反應過程中的能量變化的是(填標號)。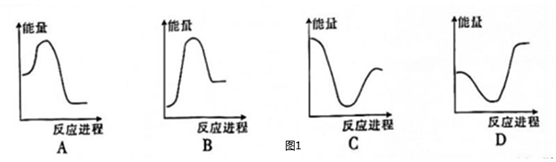
(3)該化學興趣小組用如圖2所示裝置設計了實驗,驗證碳酸鈉、碳酸氫鈉分別與稀鹽酸反應的熱效應。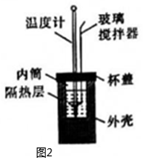
表格一:
表格二:試劑1 試劑2混合前溫度/℃ 混合后溫度/℃ 0.5gNa2CO3 40mLHCl、19.0 21.7 0.5gNaHCO3 40mLHCl、19.0 18.1
表格三:試劑1 試劑2混合
前溫度/℃溶解后溫
度/℃靜置后的
溫度/℃試劑3混合
前溫度/℃混合后
溫度/℃0.5gNa2CO3 10mLH2O19.0 22.3 19.0 10mLH2O19.0 19.0 0.5gNaHCO3 10mLH2O19.0 17.5 19.0 10mLH2O19.0 19.0
實驗操作:將試劑1與試劑2混合,測混合后溶液的溫度,靜置,冷卻至定溫,再將試劑3與之前的混合溶液混合,再測混合溶液的溫度。試劑1 試劑2混合
前溫度/℃溶解后溫
度/℃靜置后的
溫度/℃試劑3混合
前溫度/℃混合后
溫度/℃0.5gNa2CO3 10mLH2O、19.0 22.3 19.0 10mLHCl、19.0 20.5 0.5gNaHCO3 10mLH2O、19.0 17.5 19.0 10mLHCl、19.0 18.3
①實驗中玻璃攪拌器的使用方法是。
②表格二對應實驗得出的結論是。
③反應III:Na2CO3(s)+2H+(aq)=2Na+(aq)+H2O(1)+CO2(g)△H3;反應IV:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(l)+CO2(g)△H4。則△H1(填“>”、“<”或“=”,下同)△H3,△H2△H4。組卷:7引用:1難度:0.5


