2023-2024學年重慶市縉云教育聯盟高二(上)質檢化學試卷(9月份)
發布:2024/9/10 0:0:8
-
1.已知:101Ka時,1molH2完全燃燒生成液態水,放出285.8kJ的熱量;1molCH4完全燃燒生成液態水和CO2,放出890.3kJ的熱量。下列熱化學方程式的書寫正確的是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890.3kJ/mol
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol
④2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/molA.僅有②④ B.僅有② C.僅有②③④ D.全部 組卷:19引用:2難度:0.6 -
2.熱化學方程式2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ?mol-1中,化學式前面的化學計量數表示( )
A.分子數 B.體積 C.質量 D.物質的量 組卷:30引用:6難度:0.9 -
3.下列說法不正確的是( )
A.物質發生化學變化都伴有能量的變化 B.放熱反應不需要加熱就能反應,吸熱反應不加熱就不能反應 C.BaCO3(s)+BaO(s)+CO2(g)室溫下不能自發進行,說明該反應的ΔH>0 D.已知:2C(s)+2O2(g)=2CO2(g) ΔH=akJ?mol-1;2C(s)+O2(g)=2CO(g) ΔH=bkJ?mol-1,則a<b 組卷:24引用:2難度:0.7 -
4.下列依據熱化學方程式得出的結論正確的是( )
選項 熱化學方程式 結論 A 2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1 H2的燃燒熱為241.8kJ?mol-1 B OH-(aq)+H+(aq)═H2O(l)△H=-57.3kJ?mol-1 含1mol NaOH的稀溶液與濃H2SO4完全中和,放出熱量小于57.3kJ C 2C(s)+2O2(g)═2CO2(g)△H=-akJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-bkJ?mol-1b<a D C(石墨,s)=C(金剛石,s)△H=+1.5kJ?mol-1 全剛石比石墨穩定 A.A B.B C.C D.D 組卷:66引用:8難度:0.7 -
5.下列傳統文化描述中,沒有發生放熱反應的是( )
A.北宋?王安石“爆竹聲中一歲除,春風送暖入屠蘇” B.明?于謙“千錘萬鑿出深山,烈火焚燒若等閑” C.宋?蘇軾“投泥潑水愈光明,爍玉流金見精悍” D.唐?張九齡“松葉堪為酒,春來釀幾多” 組卷:10引用:3難度:0.7 -
6.工業上乙烯催化氧化制乙醛的某一反應原理為2CH2═CH2(g)+O2(g)
2CH3CHO(aq)△H,該反應原理可以拆解為如下三步反應:PdCl2-CuCl2-HCl-H2O
Ⅰ.CH2═CH2(g)+PdCl2(aq)+H2O(l)═CH3CHO(aq)+Pd(s)+2HCl(aq)△H1
Ⅱ.……
Ⅲ.4CuCl(s)+O2(g)+4HCl(aq)═4CuCl2(aq)+2H2O(l)△H3
若第Ⅱ步反應的反應熱為△H2,且△H=2△H1+2△H2+△H3,則第Ⅱ步反應的熱化學方程式為( )A.PdCl2(aq)+2CuCl(s)═Pd(s)+2CuCl2(aq)△H2 B.2Pd(s)+4CuCl2(aq)═2PdCl2(aq)+4CuCl(s)△H2 C.Pd(s)+2CuCl2(aq)═PdCl2(aq)+2CuCl(s)△H2 D.2PdCl2(aq)+4CuCl(s)═2Pd(s)+4CuCl2(aq)△H2 組卷:55引用:3難度:0.7
解答題
-
17.某實驗小組用0.50mol?L-1NaOH溶液和0.50mol?L-1硫酸溶液進行中和熱的測定。
(一)配制0.50mol?L-1NaOH溶液。
(1)若實驗中大約要使用245mLNaOH溶液,至少需要稱量NaOH固體g。
(2)從圖中選擇稱量NaOH固體所需要的儀器(填字母)。
(二)測定稀硫酸和稀氫氧化鈉反應的中和熱的實驗裝置如圖所示。序號 a b c d e f 儀器 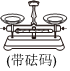





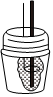
(3)寫出該反應的熱化學方程式(中和熱ΔH=-57.3kJ?mol-1):。
(4)取50mLNaOH溶液和30mL硫酸溶液進行實驗,實驗數據如下表。
①請填寫表中的空白:
②近似認為0.50mol?L-1NaOH溶液和0.50mol?L-1硫酸溶液的密度都是1g?cm-3,中和后生成溶液的比熱容C=4.18J?g-1?℃-1。則測得中和熱ΔH=實驗次數 起始溫度T1/℃ 終止溫度T2/℃ 溫度差平均值
(T2-T1)/℃H2SO4 NaOH 平均值 1 26.2 26.0 26.1 30.1 2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.8 4 26.4 26.2 26.3 30.4 kJ?mol-1(取小數點后一位)。
③上述實驗數值結果與57.3kJ?mol-1有偏差,產生偏差的原因可能是(填字母)。
A.實驗裝置保溫、隔熱效果差
B.分多次把NaOH溶液倒入盛有硫酸的小燒杯中
C.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度組卷:9引用:1難度:0.7 -
18.Ⅰ.將50mL0.50mol/L鹽酸和50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和反應反應熱。回答下列問題:
(1)從實驗裝置上看,圖中尚缺少的一種玻璃儀器是。
(2)中和熱測定實驗中,下列說法不正確的是。
A.改用60mL0.50mol/L鹽酸跟50mL0.55mol/LNaOH溶液進行反應,求出的中和熱數值和原來不同
B.酸堿混合時,量筒中NaOH溶液應分三次倒入小燒杯中
C.所加NaOH溶液過量,目的是保證鹽酸完全被中和
D.裝置中隔熱層的作用是保溫隔熱、減少熱量損失
(3)他們記錄的實驗數據如下:
(已知:Q=cm(t2-t1),反應后溶液的比熱容c為4.2kJ/(℃?kg),各物質的密度均為1g?cm-3)實驗用品 溶液溫度 中和熱 t1 t2 ΔH ① 50mL0.55mol?L-1NaOH溶液 50mL0.5mol?L-1HCl溶液 20℃ 23.3℃ ② 50mL0.55mol?L-1NaOH溶液 50mL0.5mol?L-1HCl溶液 20℃ 23.5℃
①根據實驗結果計算出NaOH溶液與HCl溶液反應的中和熱ΔH=kJ?mol-1。
②若實驗過程中,內筒未加杯蓋,求得的中和反應反應熱數值(填“偏大”“偏小”或“無影響”)。
③若用醋酸代替HCl做實驗,對測定結果(填“偏大”“偏小”或“無影響”)。
Ⅱ.某課外活動小組用如圖所示的實驗裝置探究氯氣與氨氣之間的反應。其中A、F為氨氣和氯氣的發生裝置,C為純凈、干燥的氯氣與氨氣反應的裝置。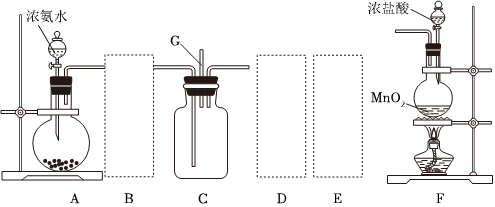
請回答下列問題:
(4)裝置A中的燒瓶內固體不可選用(填字母)。
A.堿石灰
B.燒堿
C.生石灰
D.五氧化二磷
(5)虛線框內應添加必要的除雜裝置,請從如圖的備選裝置中選擇,并將編號填入下列空格:
B、D、E從左至右依次選擇的裝置順序為備選裝置 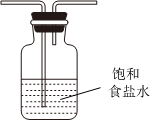
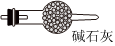
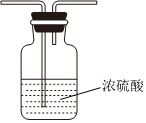
Ⅰ Ⅱ Ⅲ 。
(6)氯氣和氨氣在常溫下混合就能發生反應,現象為產生白煙,則C中反應的化學方程式為。
(7)某研究小組設計了一套制備及檢驗SO2部分性質的裝置: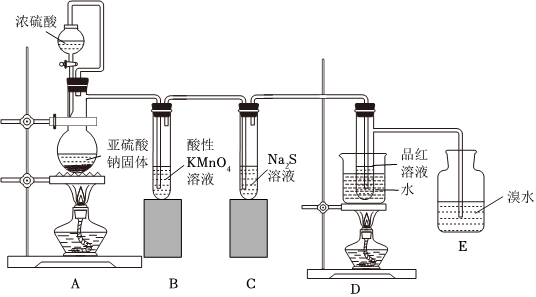
實驗過程中觀察到裝置B中的現象是,反應的離子方程式為,C裝置證明SO2具有性。
(8)E中的化學反應方程式為。
(9)D裝置的作用是。組卷:12引用:1難度:0.5


