2021-2022學(xué)年天津?qū)嶒?yàn)中學(xué)高三(上)月考化學(xué)試卷(12月份)
發(fā)布:2024/4/20 14:35:0
一、單項(xiàng)選擇題(每題只有一個(gè)正確選項(xiàng),每題3分,共36分)
-
1.下列說(shuō)法中正確的是( )
A.“五糧液”釀酒的原理是通過(guò)蒸餾法將高粱等糧食中的乙醇分離出來(lái) B.“水滴石穿”與反應(yīng)CaCO3+H2O+CO2═Ca(HCO3)2有關(guān) C.《易經(jīng)》中記載:“澤中有火”“上火下澤”。火是由“澤”中產(chǎn)生的CO燃燒引起的 D.“水過(guò)鴨背不留珠”是因?yàn)轼喿拥挠鹈韺痈缓碱愇镔|(zhì) 組卷:5引用:2難度:0.6 -
2.下列說(shuō)法不正確的是( )
A.乙二醇的沸點(diǎn)比乙醇的沸點(diǎn)高 B.淀粉和蔗糖水解的最終產(chǎn)物中均含有葡萄糖 C.植物油通過(guò)催化加氫可轉(zhuǎn)變?yōu)榘牍虘B(tài)的脂肪 D.硫酸銨或氯化鈉溶液都能使蛋白質(zhì)發(fā)生變性 組卷:142引用:3難度:0.6 -
3.下列化學(xué)用語(yǔ)表示正確的是( )
A.CO2的比例模型: 
B.次氯酸結(jié)構(gòu)式:H-Cl-O C.NH3分子的電子式: 
D.硫離子的結(jié)構(gòu)示意圖:  組卷:45引用:6難度:0.6
組卷:45引用:6難度:0.6 -
4.NA為阿伏加德羅常數(shù)的值,下列說(shuō)法不正確的是( )
A.78g苯(C6H6)和苯乙烯(C8H8)的混合物中含有的σ鍵數(shù)一定為12NA B.0.1moH2和0.1molI2于密閉容器中充分反應(yīng)后,其分子總數(shù)為0.2NA C.12g金剛石中含有化學(xué)鍵的數(shù)目為4NA D.1L1mol?L-1的NH4Br溶液中通入適量氨氣后呈中性,此時(shí)溶液中NH4+的數(shù)目為NA 組卷:7引用:1難度:0.6 -
5.室溫下,下列各組微粒在指定溶液中能大量共存的是( )
A.pH=1的無(wú)色溶液中:CH3CH2OH、Cr2O72-、K+、SO42- B.c(Ca2+)=0.1mol?L-1的溶液中:NH4+、SO32-、Cl-、Br- C.含大量HCO3-的溶液中:C6H5O-、CO32-、Br-、K+ D.能使甲基橙變?yōu)槌壬娜芤海篘a+、NH4+、CO32-、Cl- 組卷:28引用:3難度:0.6
二、填空題(共4題,共64分)
-
15.三氯化氧磷(POCl3)是一種重要的化工原料,常用作半導(dǎo)體摻雜劑及光導(dǎo)纖維原料。一研究小組在實(shí)驗(yàn)室模擬PCl3+SO2+Cl2→POCl3+SOCl2制備POCl3并測(cè)定產(chǎn)品含量。反應(yīng)裝置圖如圖(加熱、夾持裝置已省略)。

【資料卡片】
請(qǐng)回答下列問(wèn)題:物質(zhì) 熔點(diǎn)/℃ 沸點(diǎn)/℃ 相對(duì)分子質(zhì)量 其他 PCl3 ?93.6 76.1 137.5 遇水劇烈水解,易與O2反應(yīng) POCl3 1.25 105.8 153.5 遇水劇烈水解,能溶于PCl3 SOCl2 ?105 78.8 119 遇水劇烈水解,受熱易分解
(1)實(shí)驗(yàn)室制備氯氣的離子方程式是。
(2)溶液A為飽和食鹽水,乙裝置中應(yīng)該盛裝的試劑為(填“P2O5”“堿石灰”“濃H2SO4”);反應(yīng)裝置圖的虛框中未畫出的儀器最好選擇(填“己”或“庚”)。
(3)甲、丁裝置的作用除了用于氣體的凈化除雜外,還有。
(4)水浴加熱三頸燒瓶,控制反應(yīng)溫度在60~65℃,其原因是。
(5)通過(guò)佛爾哈德法可測(cè)定經(jīng)過(guò)提純后的產(chǎn)品中POCl3的含量:準(zhǔn)確稱取1.600g樣品在水解瓶中搖動(dòng)至完全水解,將水解液配成100mL溶液,取10.00mL于錐形瓶中,加入0.2000mol?L-1的AgNO3溶液20.00mL(Ag++Cl-═AgCl↓),再加少許硝基苯,用力振蕩,使沉淀被有機(jī)物覆蓋。加入NH4Fe(SO4)2作指示劑,用0.1000mol?L-1KSCN標(biāo)準(zhǔn)溶液滴定過(guò)量的AgNO3至終點(diǎn)(Ag++SCN-═AgSCN↓),做平行實(shí)驗(yàn),平均消耗KSCN標(biāo)準(zhǔn)溶液10.00mL。
①達(dá)到滴定終點(diǎn)的現(xiàn)象是。
②POCl3的質(zhì)量分?jǐn)?shù)為(保留三位有效數(shù)字)。
③已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,若無(wú)硝基苯覆蓋沉淀表面,測(cè)定POCl3的質(zhì)量分?jǐn)?shù)將(填“偏大”“偏小”或“無(wú)影響”)。組卷:3引用:1難度:0.5 -
16.治理大氣和水體污染對(duì)建設(shè)美麗家鄉(xiāng),打造宜居環(huán)境具有重要意義。
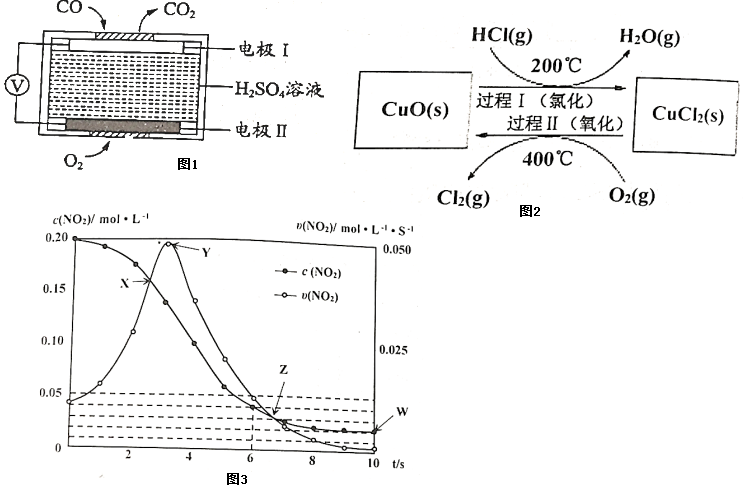
(1)CO泄漏會(huì)導(dǎo)致人體中毒,用于檢測(cè)CO的傳感器的工作原理如圖1所示:寫出電極Ⅰ上發(fā)生的反應(yīng)式:工作一段時(shí)間后溶液中H2SO4的濃度(填“變大”、“變小”或“不變”)
(2)用O2氧化HCl制取Cl2,可提高效益,減少污染。
反應(yīng)為:4HCl(g)+O22Cl2(g)+2H2O(g)△H,通過(guò)控制條件,分兩步循環(huán)進(jìn)行,可使HCl轉(zhuǎn)化率接近100%,其原理如圖2所示:CuO/CuCl2
過(guò)程Ⅰ的反應(yīng)為:2HCl(g)+CuO(s)?CuCl2(s)+H2O(g)△H1
過(guò)程Ⅱ反應(yīng)的熱化學(xué)方程式(△H2用含有△H和△H1的代數(shù)式表示)。
(3)在溫度T0℃,容積為1L的絕熱容器中,充入0.2mol NO2,發(fā)生反應(yīng):2NO2(g)?N2O4(g)△H<0
,容器中NO2的相關(guān)量隨時(shí)間變化如圖3所示。
①反應(yīng)到6s時(shí),NO2的轉(zhuǎn)化率是。
②根據(jù)圖示,以下各點(diǎn)表示反應(yīng)達(dá)到平衡狀態(tài)的是。
a.X
b.Y
c.Z
d.W
③0~3s內(nèi)容器中NO2的反應(yīng)速率增大,而3s后容器中NO2的反應(yīng)速率減小了,原因是。
④此容器中反應(yīng)達(dá)平衡時(shí),溫度若為T1℃,此溫度下的平衡常數(shù)K=。
(4)工業(yè)上可用Na2SO3溶液吸收法處理SO2,25℃時(shí)用1mol?L-1的Na2SO3溶液吸收SO2,當(dāng)溶液pH=7時(shí),溶液中各離子濃度的大小關(guān)系為:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。(已知25℃時(shí):H2SO3的電離常數(shù)Ka1=1.3×10-2,Ka2=6.2×10-8)請(qǐng)結(jié)合所學(xué)理論通過(guò)計(jì)算說(shuō)明c(HSO3-)>c(SO32-)的原因。組卷:70引用:3難度:0.5


