2020年江蘇省南京師大附中高考化學押題試卷(6月份)
發布:2024/4/20 14:35:0
一、選擇題(共10小題,每小題2分,滿分20分)
-
1.化學與人類生活、社會可持續發展密切相關。下列說法不正確的是( )
A.采用納米TiO2光觸媒技術將裝修材料中釋放的HCHO轉化為無害物質 B.用CO2合成可降解的聚碳酸酯塑料,可以實現“碳”的循環利用 C.減少對化石燃料的依賴,有效降低PM2.5對環境的污染 D.目前汽油標準已由“國Ⅲ”提到“國Ⅳ”,這意味著汽車不再排放氮氧化物 組卷:107引用:2難度:0.5 -
2.下列有關化學用語表示正確的是( )
A.甲酸甲酯的實驗式:CH2O B.丙烯醛的結構簡式:CH2CHCHO C.氮氣分子的電子式: 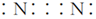
D.H2CO3的電離方程式:H2CO3?2H++CO32- 組卷:25引用:1難度:0.8 -
3.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.使pH試紙變藍的溶液中:NH4+、Na+、Cl-、ClO- B.1.0mol?L-1的HNO3溶液中:K+、[Ag(NH3)2]+、Cl-、SO42- C. =1的溶液中:Fe2+、AlO2-、Al3+、I-c(OH-)c(H+)D.0.1mol?L-1的NH4HCO3溶液中:K+、Na+、NO3-、Cl- 組卷:95引用:3難度:0.6 -
4.下列有關物質的性質與應用不對應的是( )
A.福爾馬林能使蛋白質變性,可用于浸泡標本 B.油脂在堿性條件下易水解,可用于制作肥皂 C.NH3分解生成N2和H2吸收熱量,液氨可用作制冷劑 D.ClO2具有強氧化性,可用于自來水的殺菌消毒 組卷:34引用:1難度:0.6 -
5.用下列實驗裝置進行相應的實驗,能達到實驗目的的是( )
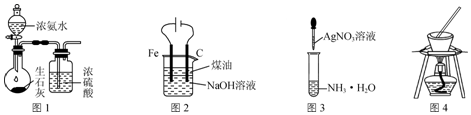
A.用圖1裝置制取干燥的氨氣 B.用圖2裝置制備Fe(OH)2并能較長時間觀察其顏色 C.用圖3裝置配制銀氨溶液 D.用圖4裝置從食鹽水中提取NaCl 組卷:40引用:2難度:0.5 -
6.下列敘述不正確的是( )
A.植物油含不飽和脂肪酸酯,能使Br2的CCl4溶液褪色 B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃試劑瓶中 C.SO2通入到紫色石蕊試液中,溶液先變紅后褪色 D.除去Mg(OH)2濁液中的Ca(OH)2,可加入足量MgCl2溶液充分攪拌后過濾 組卷:38引用:2難度:0.6 -
7.下列指定反應的離子方程式正確的是( )
A.MnO2與濃鹽酸混合加熱:MnO2+4H++4Cl- MnCl2+Cl2↑+2H2O△B.氫氧化鋇溶液中加入硫酸銨:Ba2++OH-+NH4++SO42-═BaSO4↓+NH3?H2O C.FeSO4溶液中加入鹽酸酸化的H2O2:Fe2++H2O2+2H+═Fe3++2H2O D.0.01mol?L-1NH4Al(SO4)2溶液與0.02mol?L-1Ba(OH)2溶液等體積混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O 組卷:162引用:1難度:0.5
三、解答題(共6小題,滿分80分)
-
20.水是生命之源。
(1)關于反應H2(g)+O2(g)═H2O(l),下列說法正確的是12。(填字母)
A.焓變△H<0,熵變△S<0
B.可以把反應設計成原電池,實現能量的轉化
C.該反應在常溫下不易被觀察,因為具有較高的活化能,反應速率小
D.選用合適的催化劑,有可能使反應在常溫常壓下以較快的速率進行
(2)電滲析法淡化海水裝置示意圖如圖1所示,在電場中利用膜技術可以實現淡化海水和濃縮海水的分離。
①圖1中膜a應選用。(填“陽離子”或“陰離子”)交換膜
②各間隔室的排出液中,A為。(填“淡化海水”或“濃縮海水”)
③電滲析法還可用來處理電鍍廢液,寫出用該方法處理含AgNO3廢液時所發生反應的化學反應方程式:。
(3)水在高溫高壓狀態下呈現許多特殊的性質。當溫度、壓強分別超過臨界溫度(374.2℃)、臨界壓強(22.1MPa)時的水稱為超臨界水。
①如果超臨界水的電離度變為常溫下的100倍,則此時Kw的值為。
②超臨界水能夠與氧氣等氧化劑以任意比例互溶,由此發展了超臨界水氧化技術。一定實驗條件下,測得乙醇的超臨界水氧化結果如圖2,其中x為以碳元素計的物質的量分數,如xCO=,t為反應時間,CO的分布分數先增后降的原因是n(CO)n(所有含C物質)。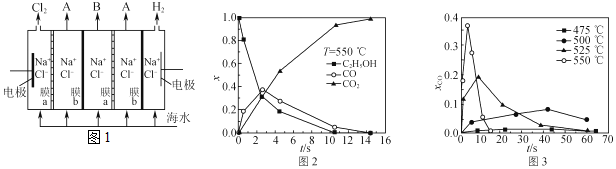
③不同溫度下乙醇的超臨界水氧化過程中CO的分布分數隨時間變化如圖3所示,隨著溫度升高,CO分布分數峰值出現的時間提前且峰值更高的原因是。組卷:45引用:2難度:0.5 -
21.均由兩種短周期元素組成的A、B、C、D化合物分子,都含有18個電子,它們分子中所含原子的數目依次為2、3、4、6.A和C分子中的原子個數比為1:1,B和D分子中的原子個數比為1:2.D可作為火箭推進劑的燃料。請回答下列問題:
(1)A、B、C、D分子中相對原子質量較大的四種元素第一電離能由大到小排列的順序為(用元素符號表示)。
(2)A與HF相比,其熔、沸點較低,原因是。
(3)B分子屬于(填“極性”或“非極性”)分子。
(4)D分子中心原子的雜化方式是,由該原子組成的單質分子中包含個π鍵,與該單質分子互為等電子體的常見分子的分子式為。
(5)[Fe(H2O)6]2+與NO反應生成的[Fe(NO)(H2O)5]2+中,NO以N原子與Fe2+形成配位鍵。請畫出[Fe(NO)(H2O)5]2+結構示意圖:。組卷:35引用:1難度:0.6


