2021-2022學(xué)年內(nèi)蒙古呼倫貝爾市海拉爾二中高三(上)第一次段考化學(xué)試卷
發(fā)布:2024/11/16 10:30:2
一、單選題(每題3分,共45分)
-
1.中華傳統(tǒng)文化蘊(yùn)含著豐富的化學(xué)知識,下列詩句中主要涉及吸熱反應(yīng)的是( )
A.白居易《賦得古原草送別》:“野火燒不盡,春風(fēng)吹又生。” B.蘇軾《石炭》:“投泥潑水愈光明,爍玉流金見精悍。” C.于謙《詠煤炭》:“爝火燃回春浩浩,烘爐照破夜沉沉。” D.李商隱《相見時難別亦難》:“春蠶到死絲方盡,蠟炬成灰淚始干。” 組卷:168引用:16難度:0.8 -
2.現(xiàn)有2.0g含Na2O雜質(zhì)的Na2O2樣品,用如圖的實驗裝置測定Na2O2試樣的純度,(可供選用的反應(yīng)物只有CaCO3固體、鹽酸、硫酸和蒸餾水)下列說法錯誤的是( )
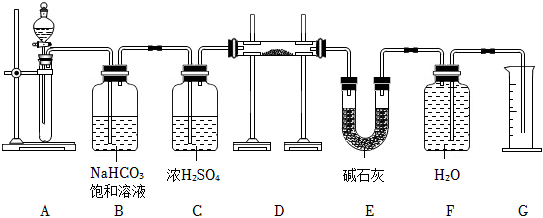
A.裝置A中液體試劑為鹽酸 B.裝置B的作用是除去揮發(fā)出的HCl氣體 C.若去掉裝置E會導(dǎo)致所測Na2O2試樣的純度偏低 D.若反應(yīng)結(jié)束后由氣體體積計算得氣體質(zhì)量為0.32g,則Na2O2試樣的純度為78% 組卷:46引用:6難度:0.5 -
3.用H2O2和H2SO4的混合溶液可溶出廢舊印刷電路板上的銅.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H?+64.39kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H?-196.46kJ?mol-1
H2(g)+O2(g)═H2O(l)△H?-285.84kJ?mol-112
在H2SO4溶液中,Cu與H2O2反應(yīng)生成Cu2+(aq)和H2O(l)的反應(yīng)熱△H等于( )A.-417.91kJ?mol-1 B.-319.68 kJ?mol-1 C.+546.69 kJ?mol-1 D.-448.46 kJ?mol-1 組卷:427引用:16難度:0.9 -
4.用NA表示阿伏加德羅常數(shù)的值,下列敘述正確的是( )
A.60gHCHO與CH3COOH混合物中含C原子數(shù)為2NA B.0.5mol雄黃(As4S4結(jié)構(gòu)如圖)含有NA個S-S鍵 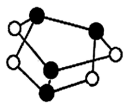
C.0.2mol FeI2 與足量氯氣反應(yīng)時轉(zhuǎn)移電子數(shù)為0.4NA D.標(biāo)準(zhǔn)狀況下,2.24LHF與1.6gCH4分子所含電子數(shù)目均為NA 組卷:2引用:1難度:0.7 -
5.利用微生物燃料電池進(jìn)行廢水處理,實現(xiàn)碳氮聯(lián)合轉(zhuǎn)化。其工作原理如圖所示,其中M、N為厭氧微生物電極。下列有關(guān)敘述錯誤的是( )
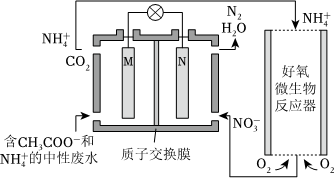
A.負(fù)極的電極反應(yīng)為CH3COO--8e-+2H2O═2CO2↑+7H+ B.電池工作時,H+由M極移向N極 C.相同條件下,M、N兩極生成的CO2和N2的體積之比為3:2 D.好氧微生物反應(yīng)器中發(fā)生的反應(yīng)為 +2O2═NH+4+2H++H2ONO-3組卷:189引用:10難度:0.7 -
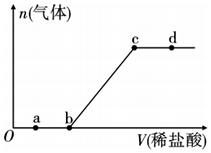 6.向Na2CO3、NaHCO3混合溶液中滴加稀鹽酸,生成氣體的量隨稀鹽酸加入量的變化關(guān)系如圖所示,則下列離子組在對應(yīng)的溶液中一定能大量共存的是( )
6.向Na2CO3、NaHCO3混合溶液中滴加稀鹽酸,生成氣體的量隨稀鹽酸加入量的變化關(guān)系如圖所示,則下列離子組在對應(yīng)的溶液中一定能大量共存的是( )A.a(chǎn)點對應(yīng)的溶液中:Fe3+、Fe2+、NO3-、SO42- B.b點對應(yīng)的溶液中:AlO2-、Na+、ClO-、SO42- C.c點對應(yīng)的溶液中:Na+、Ca2+、Ba2+、Cl- D.d點對應(yīng)的溶液中:F-、NO3-、SO42-、Cl- 組卷:6引用:3難度:0.6 -
7.研究表明,采用零價鐵(ZVI)活化過硫酸鈉(Na2S2O8,其中S為+6價)可去除廢水中的正五價砷[As(V)],其反應(yīng)機(jī)理模型如圖所示(
●、●OH表示自由基),定義比表面積為單位質(zhì)量的物質(zhì)所具有的表面積。設(shè)阿伏加德羅常數(shù)的值為NA.下列敘述錯誤的是( )SO-4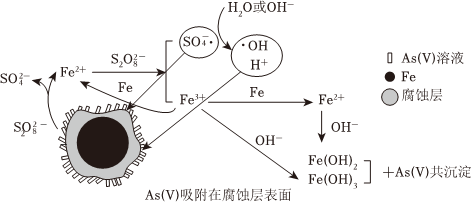
A.過硫酸鈉中-2價氧與-1價氧的個數(shù)比為3:1 B.若56g Fe參加反應(yīng),被還原的S2 小于1.5NA個O2-8C.堿性條件下硫酸根自由基發(fā)生反應(yīng)的方程式為 ●+OH-═SO-4+●OHSO2-4D.pH越小,越有利于去除廢水中的正五價砷 組卷:18引用:3難度:0.7
二、填空題(共55分)
-
21.四氧化三錳(Mn3O4)被廣泛應(yīng)用在磁芯、磁盤、磁帶、低溫?zé)崦綦娮璧壬a(chǎn)制造中。一種以氧化錳礦為原料(含Mn2O3、MnOOH、Fe2O3、A12O3、SiO2及CuO等)經(jīng)還原浸出后用空氣氧化法制備四氧化三錳的工藝步驟如圖所示。
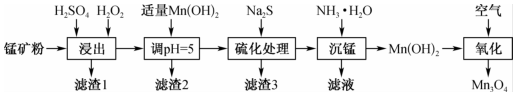
回答下列問題:
(1)四氧化三錳(Mn3O4)中錳元素的化合價有+2價和+3價,其化學(xué)式可改寫為。
A.MnO?Mn2O3
B.2MnO?MnO2
C.Mn2O?Mn2O3
D.MnO?MnO2
(2)“浸出”中Mn2O3參與反應(yīng)的離子方程式為。
(3)加入適量Mn(OH)2調(diào)節(jié)pH的目的是。
(4)“濾渣3”的主要成分有。
(5)“濾液”溶質(zhì)的主要成分是;過濾出的Mn(OH)2需要洗滌,簡要說明洗滌沉淀的操作。
(6)“氧化”時,將固體加入水中,加熱,通空氣氧化,將固體全部轉(zhuǎn)化為Mn2O3。Mn(OH)2生成Mn3O4的化學(xué)方程式為;反應(yīng)后溶液pH(填“增大”“減小”或“不變”)。組卷:15引用:2難度:0.6 -
22.高鐵酸鉀(K2FeO4)是一種新型綠色、高效的水處理劑,對病毒的去除率可達(dá)99.95%。某興趣小組設(shè)計如下實驗制備K2FeO4并探究其性質(zhì)。
已知:①K2FeO4為紫色固體,微溶于KOH溶液;
②具有強(qiáng)氧化性,在酸性或中性溶液中能快速產(chǎn)生O2,在堿性溶液中較穩(wěn)定。FeO2-4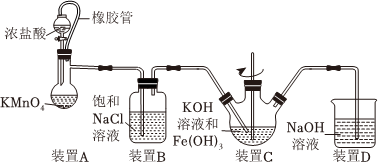
(1)制備K2FeO4(夾持裝置略)
①如圖所示,A為氯氣發(fā)生裝置,裝置A中盛放KMnO4的儀器名稱是。
②裝置C中的KOH溶液需過量,目的是。
③C中得到紫色固體和溶液,則C中Cl2與Fe(OH)3發(fā)生反應(yīng)生成K2FeO4的離子方程式為,此外Cl2還與過量的KOH反應(yīng)。
(2)探究K2FeO4的性質(zhì)
甲同學(xué)取裝置C中紫色溶液,加入稀硫酸,產(chǎn)生黃綠色氣體,經(jīng)檢驗氣體中含有Cl2。該現(xiàn)象不能證明“酸性條件下氧化性強(qiáng)于Cl2”,其理由是:FeO2-4。
(3)測定K2FeO4的產(chǎn)率
若在制備裝置C中加入Fe(OH)3的質(zhì)量為10.7g,充分反應(yīng)后經(jīng)過濾、洗滌、干燥得K2FeO4固體10.3g,則K2FeO4的產(chǎn)率為(保留3位有效數(shù)值)。組卷:14引用:6難度:0.5


