人教版(2019)選擇性必修1《3.3.2 鹽類水解的影響因素及應用》2023年同步練習卷(7)
發布:2024/8/16 14:0:1
一、選擇題
-
1.欲使醋酸鈉溶液中CH3COO-的水解程度減小,c(OH-)增大,可采用的方法是( )
A.加熱 B.加水稀釋 C.加入少量NaOH固體 D.加入少量NH4Cl固體 組卷:132引用:3難度:0.7 -
2.有等物質的量濃度下列四種溶液:a.(NH4)2SO4;b.(NH4)2CO3;c.NH4Cl;d.NH4HSO4,其中c(NH4+)大小關系判斷正確的是( )
A.a=b>c=d B.c>a>b>d C.a>c>b>d D.a>b>d>c 組卷:142引用:3難度:0.7 -
3.物質的量濃度相同的下列溶液,pH由大到小排列正確的是( )
A.Ba(OH)2、Na2CO3、FeCl3、KCl B.NaOH、Na2CO3、KNO3、NH4Cl C.NH3?H2O、HCl、Na2SO4、H2SO4 D.NaHCO3、醋酸、NaCl、HCl 組卷:204引用:3難度:0.7 -
4.在空氣中直接蒸發下列鹽的溶液,不能得到相應鹽的晶體(可以含有結晶水)的是( )
A.Al2(SO4)3 B.CuCl2 C.Na2CO3 D.KCl 組卷:46引用:3難度:0.8
三、解答題
-
 18.已知25℃時部分弱電解質的電離平衡常數數據如下表:
18.已知25℃時部分弱電解質的電離平衡常數數據如下表:
回答下列問題:化學式 CH3COOH H2CO3 HClO 平衡常數 Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 Ka=3.0×10-8
(1)物質的量濃度均為0.1mol?L一1的四種溶液:a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3,pH由小到大的排列順序是(用字母表示)
(2)常溫下,0.1mol?L-1的CH3COOH溶液加水稀釋過程中,下列表達式的數據變大的是(填序號)
A.c(H+) B.C.c(H+)?c(OH-) D.c(H+)c(CH3COOH)c(OH-)c(H+)
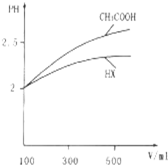
(3)體積均為100mL pH=2的CH3COOH與一元酸HX,加水稀釋過程中pH與溶液體積的關系如圖所示,則HX的電離平衡常數(填“>”、“<”或“=”)CH3COOH的電離平衡常數.
(4)25℃時,在CH3COOH與CH3COONa的混合溶液中,若測得pH=6,則溶液中:
①c(CH3COO-)-c(Na+)=mol?L-1(填精確值)
②=c(CH3COO-)c(CH3COOH).組卷:44引用:4難度:0.3 -
19.NH4Al(SO4)2常作食品加工中的食品添加劑,用于焙烤食品;NH4HSO4在分析試劑、醫藥、電子工業中用途廣泛。請回答下列問題:
(1)相同條件下,0.1mol/L?NH4Al(SO4)2溶液中的c()NH+4(填“等于”“大于”或“小于”)0.1mol/LNH4HSO4溶液中的c()。NH+4
(2)室溫時,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol?L-1NaOH溶液,溶液pH與加入NaOH溶液體積的關系曲線如圖所示。試分析圖中a、b、c、d四個點,水的電離程度最大的是點。在b點,溶液中各離子濃度由大到小的排列順序是。請寫出滴加氫氧化鈉至c點時的總離子反應方程式。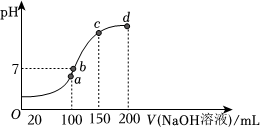 組卷:19引用:2難度:0.7
組卷:19引用:2難度:0.7


