2021-2022學年河南省鄭州市中原名校聯盟高二(上)第二次聯考化學試卷
發布:2024/12/5 0:30:2
一、選擇題(每小題3分,共48分)
-
1.下列各組關于強電解質.弱電解質.非電解質的歸類正確的( )
A B C D 強電解質 Fe NaCl CaCO3 HNO3 弱電解質 CH3COOH NH3 H2CO3 Fe(OH)3 非電解質 蔗糖 BaSO4 C2H5OH H2O A.A B.B C.C D.D 組卷:1047引用:86難度:0.7 -
2.在2 L密閉容器中,盛有2mol X和2mol Y進行如下反應:X(s)+3Y(g)?Z(g),當反應進行到10s后,測得生成0.5mol Z,則平均反應速率為( )
A.v(X)=0.5mol?L-1?s-1 B.v(X)=0.025mol?L-1?s-1 C.v(Y)=0.05mol?L-1?s-1 D.v(Y)=0.075mol?L-1?s-1 組卷:27引用:4難度:0.9 -
3.下列屬于電離方程式且書寫正確的一項是( )
A.HCO3-+H2O?H2CO3+OH- B.H2CO3?2H++CO32- C.CH3COOH+OH-?CH3COO-+H2O D.CH3COOH?CH3COO-+H+ 組卷:58引用:6難度:0.6 -
4.下列自發反應可用焓判據來解釋的是( )
A.2N2O5(g)═4NO2(g)+O2(g)△H=+56.7 kJ?mol-1 B.2H2(g)+O2(g)═2H2O(l)△H=-572 kJ?mol-1 C.(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9 kJ?mol-1 D.CaCO3(s)═CaO(s)+CO2(g)△H=+178.2 kJ?mol-1 組卷:31引用:4難度:0.9 -
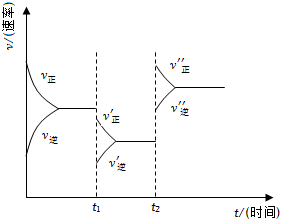 5.如圖是可逆反應A(g)+2B(g)?2C(g)+3D(g),(正反應△H>0)的化學反應速率與化學平衡隨外界條件改變而變化的關系圖,下列條件的改變與圖中情況相符的是( )
5.如圖是可逆反應A(g)+2B(g)?2C(g)+3D(g),(正反應△H>0)的化學反應速率與化學平衡隨外界條件改變而變化的關系圖,下列條件的改變與圖中情況相符的是( )A.t1時,減小了A或B的物質的量的濃度 B.t2時,升高了溫度 C.t2時,增大了壓強 D.t1時,加了催化劑 組卷:131引用:11難度:0.9 -
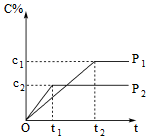 6.在一定溫度下的可逆反應:mA(g)+nB(g)?pC(g)+qD(g),生成物C的體積分數與壓強p1和p2、時間t1和t2的關系如圖所示,則下列關系正確的是( )
6.在一定溫度下的可逆反應:mA(g)+nB(g)?pC(g)+qD(g),生成物C的體積分數與壓強p1和p2、時間t1和t2的關系如圖所示,則下列關系正確的是( )
①p1>p2
②p1<p2
③m+n>p+q
④m+n=p+q
⑤m+n<p+qA.①③ B.②③ C.①④ D.②⑤ 組卷:45引用:3難度:0.7 -
7.在體積固定的密閉容器中發生反應:2SO2(g)+O2(g)?2SO3(g),t時刻測得c(SO2)=0.3mol/L、c(O2)=0.7mol/L、c(SO3)=0.4mol/L,反應在一定條件下達到平衡時,各物質的濃度可能是( )
A.c(SO2)=0.7mol?L-1 B.c(O2)=0.5mol?L-1 C.c(SO3)=0.6mol?L-1 D.c(SO2)=c(SO3)=0.32mol?L-1 組卷:73引用:4難度:0.8
二、非選擇題:本題共5小題,共52分。
-
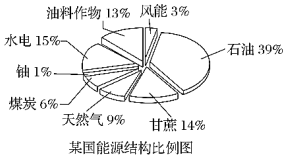 20.為緩解能源緊張,越來越多的國家開始重視生物質能源(利用能源作物和有機廢料,經過加工轉變為生物燃料的一種能源)的開發利用。
20.為緩解能源緊張,越來越多的國家開始重視生物質能源(利用能源作物和有機廢料,經過加工轉變為生物燃料的一種能源)的開發利用。
(1)如圖是某國能源結構比例圖,其中生物質能源所占的比例是。
(2)生物柴油是由動植物油脂轉化而來,其主要成分為脂肪酸酯,幾乎不含硫,生物降解性好,一些國家已將其添加在普通柴油中使用。關于生物柴油及其使用,下列說法正確的是。
①生物柴油是可再生資源
②可減少二氧化硫的排放
③與普通柴油相比易分解
④與普通柴油制取方法相同
A.①②③
B.①②④
C.①③④
D.②③④
(3)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ?mol-1
寫出表示甲醇燃燒熱的熱化學方程式。
(4)已知1g氫氣完全燃燒生成液態水時放出熱量143kJ,18g水蒸氣變成液態水放出44kJ的熱量。其他相關數據如表:
則表中x為O=O H-H H-O(g) 1mol化學鍵斷裂需要吸收的能量/kJ 496 436 x
(5)向體積為2L的固定密閉容器中通入3mol X氣體,在一定溫度下發生如下反應:2X(g)?Y(g)+3Z(g)經5min后反應達到平衡,此時測得容器內的壓強為起始時的1.2倍,則用Y表示的速率為。組卷:18引用:3難度:0.5 -
21.測定中和熱的實驗步驟如下:①用量筒量取50mL 0.50mol?L-1鹽酸倒入小燒杯中,測出鹽酸溫度;②用另一量筒量取50mL 0.55mol?L-1NaOH溶液,并用同一溫度計測出其溫度;③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測得混合液最高溫度。回答下列問題:
(1)裝置中碎泡沫塑料(或紙條)及泡沫塑料板的作用是什么。
(2)用環形玻璃攪拌棒攪拌溶液,不能用銅絲攪拌棒代替的理由是什么?。
(3)假設鹽酸和氫氧化鈉溶液的密度都是1g?cm-3,又知中和反應后生成溶液的比熱容c=4.18J?g-1?℃-1。為了計算中和熱,某學生實驗記錄數據如下表:
依據該學生的實驗數據計算,該實驗測得的中和熱△H=實驗序號 起始溫度t1/℃ 終止溫度t2/℃ 混合溶液 鹽酸 氫氧化鈉溶液 1 20.0 20.1 23.2 2 20.2 20.4 23.4 3 20.5 20.6 23.6 (結果保留一位小數)。
(4)不能用Ba(OH)2溶液和硫酸代替氫氧化鈉液和鹽酸,理由是。
(5)現將一定量的稀氫氧化鈉溶液、稀氫氧化鈣溶液、稀氨水分別和1L 1mol?L-1的稀鹽酸恰好完全反應,其反應熱分別為△H1、△H2、△H3,則△H1、△H2、△H3的大小關系為。組卷:23引用:2難度:0.6


