2021年福建省莆田二中、泉州一中、南安一中三校高考化學聯(lián)考試卷
發(fā)布:2024/4/20 14:35:0
一、單項選擇題(每小題3分,共14小題,共42分)
-
1.用下列實驗裝置和方法進行相應實驗,能達到實驗目的的是( )
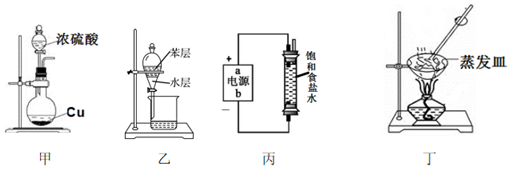
A.用裝置甲制備SO2 B.用裝置乙從碘水溶液中萃取碘 C.裝置丙用于制備少量含NaClO的消毒液 D.用裝置丁蒸干溶液獲得(NH4)2CO3晶體 組卷:6引用:1難度:0.5 -
2.安全氣囊碰撞時發(fā)生反應:10NaN3+2KNO3═K2O+5Na2O+16N2↑,下列判斷正確的是( )
A.每生成16 mol N2轉移30 mol電子 B.NaN3中N元素被還原 C.N2既是氧化劑又是還原劑 D.還原產(chǎn)物與氧化產(chǎn)物質(zhì)量之比為1:15 組卷:61引用:14難度:0.7 -
3.下列有關說法正確的是( )
①生產(chǎn)熔噴布口罩的原料聚丙烯是純凈物,在“新冠戰(zhàn)疫”中發(fā)揮了重要作用
②明礬溶于水可水解生成Al(OH)3膠體,因此可用明礬對自來水進行殺菌消毒
③分解、電解、潮解、裂解都是化學變化
④膠體與其他分散系的本質(zhì)區(qū)別是分散質(zhì)粒子直徑的大小
⑤淀粉、蛋白質(zhì)、纖維素、油脂都是高分子化合物,氨水、王水、雙氧水都是混合物
⑥元素處在最高價態(tài)時只有強氧化性,最低價態(tài)時只有強還原性
⑦CO2、NH3的水溶液能導電,所以CO2、NH3均是電解質(zhì)A.1個 B.2個 C.3個 D.4個 組卷:50引用:4難度:0.8 -
4.根據(jù)下列實驗操作和現(xiàn)象所得出的結論正確的是( )
選項 實驗操作和現(xiàn)象 結論 A 向某黃色溶液中加入淀粉KI溶液,溶液呈藍色 溶液中含Br2 B 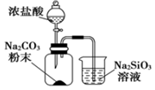 燒杯中看見白色沉淀
燒杯中看見白色沉淀證明酸性強弱:H2CO3>H2SiO3 C 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液變黃 氧化性:H2O2>Fe3+ D 取5mL 0.1mol?L-1 KI溶液,加入1mL 0.1mol?L-1 FeCl3溶液,萃取分液后,向水層滴入KSCN溶液,溶液變成血紅色 Fe3+與I-所發(fā)生的反應為可逆反應 A.A B.B C.C D.D 組卷:6引用:1難度:0.5 -
5.設NA為阿伏加德羅常數(shù)的值。下列說法正確的是( )
A.120.0g NaHSO4與MgSO4的固體混合物中含有離子總數(shù)為2NA B.1.0L 1.0mol?L-1的NaHCO3水溶液中含有的氧原子數(shù)為3NA C.0.1mol Fe恰好溶解在100mL某濃度的硝酸溶液中,該反應轉移的電子數(shù)為0.3NA D.60.0g的SiO2含有2NA個極性鍵 組卷:46引用:6難度:0.7 -
6.25℃時,下列各組離子在指定溶液中一定能大量共存的是( )
A.中性溶液中:NH4+、Fe3+、SO42-、Cl- B.0.1mol/L的NH4HCO3溶液中:K+、SiO32-、[Al(OH)4]-、Cl- C. =1×10-12 mol/L的溶液中:K+、NO3-、S2-、ClO-Kwc(H+)D.透明的溶液中:K+、NH4+、MnO4-、CO32- 組卷:15引用:1難度:0.7
二.填空題(5大題,共58分)
-
19.PbCO3廣泛用于陶瓷、油漆和顏料配制等。一種由方鉛礦(主要成分為PbS,含少量FeS)和軟錳礦(主要成分為MnO2)為原料制備PbCO3的流程如圖:
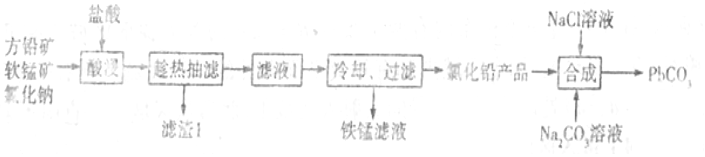
已知:①“酸浸”時PbS反應的方程式為PbS+MnO2+4Cl-+4H+═PbCl42-+Mn2++S+2H2O.PbCl2易溶于熱水,難溶于冷水。在鹽酸中因與Cl-形成配合離子PbCl42-而增大PbCl2的溶解度。
②常溫下,幾種金屬離子沉淀的pH如下:
(1)“酸浸”之前需要將方鉛礦、軟錳礦和氧化鈉粉碎并混合均勻,其目的是氫氧化物 Fe(OH)3 Fe(OH)2 Mn(OH)2 開始沉淀的pH 1.5 7.5 8.8 完全沉淀的pH 2.3 9.7 10.4 。
(2)“趁熱抽濾”的目的是。
(3)鐵錳濾液中陽離子主要是Mn2+,還含少量Fe3+、Fe2+.從鐵錳濾液中得到較純錳鹽溶液有兩種方案:
方案甲:向濾液中加入酸化的雙氧水,再加入足量MnCO3粉末,過濾得到錳鹽溶液。
方案乙:向濾液中加入稀硫酸酸化,然后加入二氧化錳粉末,充分反應;最后,加氨水調(diào)節(jié)溶液pH,過濾。
①方案甲中加入MnCO3的目的是。
②用離子方程式表示方案乙中“加入二氧化錳”的作用:。
已知常溫下,Ksp[Fe(OH)3]≈1.0×10-38,為了使溶液中c(Fe3+)=1.0×10-5mol?L-1,此時溶液的pH=。
③從操作、產(chǎn)品純度角度考慮,方案(填“甲”或”乙”)優(yōu)于另一種方案。
(4)研究工業(yè)生產(chǎn)中溫度對浸出率的影響如圖所示,則生產(chǎn)中浸出過程的最佳溫度是。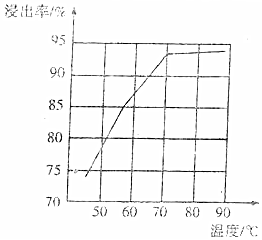
(5)向氯化鉛(難溶于水)產(chǎn)品中加入氯化鈉溶液和碳酸鈉溶液,得到碳酸鉛產(chǎn)品后,要經(jīng)過“過濾、洗滌、干燥”等操作,檢驗碳酸鉛是否洗滌干凈的操作是。組卷:14引用:2難度:0.5 -
20.黃色超氧化鉀(KO2)可作為宇宙飛船艙的氧源。某學習小組設計以下實驗探究KO2的性質(zhì),請回答相關問題:
探究KO2與SO2的反應: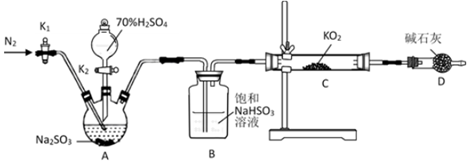
(1)檢查上述裝置氣密性的方法是。
(2)正確的操作依次是。(操作可重復選擇)
①打開K1通入N2,并維持一段時間后關閉
②實驗完成,拆卸裝置
③檢查裝置氣密性,然后裝入藥品
④打開分液漏斗活塞K2
(3)A裝置發(fā)生反應的化學方程式為。
(4)用上述裝置驗證“KO2與SO2反應生成O2”還存在不足,你的改進措施是。
(5)改進后再實驗,待KO2完全反應后,將裝置C中固體加水溶解,配成50.00 mL溶液,等分為M、N兩份。
①向M溶液中加入足量的鹽酸酸化的BaCl2溶液,充分反應后,將沉淀過濾、洗滌、干燥,稱重為4.66 g。
②將N溶液移入錐形瓶中,用0.20 mol?L-1酸性KMnO4溶液滴定,當出現(xiàn)現(xiàn)象時,達到滴定終點,此時消耗酸性KMnO4溶液20.00 mL。
③依據(jù)上述現(xiàn)象和數(shù)據(jù),請寫出裝置C中總反應的化學方程式。組卷:18引用:1難度:0.5


