2021-2022學年福建省三明市寧化六中高二(下)第一次月考化學試卷
發布:2024/4/20 14:35:0
一.選擇題:(每小題3分,共48分,每小題均只有一個選項符合題意)
-
1.以下能級符號不正確的是( )
A.3s B.3p C.3d D.3f 組卷:358引用:39難度:0.9 -
2.下列各原子或離子的電子排布式正確的是( )
A.Cu:[Ar]3d94s2 B.Al3+:1s22s22p6 C.Br的價電子:3d104s24p5 D.Mn:1s22s22p63s23p63d7 組卷:16引用:2難度:0.8 -
3.d軌道中電子排布成
 而不是排布成
而不是排布成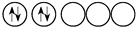 其最直接的根據是( )
其最直接的根據是( )A.洪特規則 B.泡利不相容原理 C.能量最低原則 D.能量守恒原理 組卷:31引用:2難度:0.6 -
4.某元素的一種基態原子的M電子層p能級上有4個電子,有關該原子的敘述錯誤的是( )
A.N層不含有電子 B.L層一定有8個電子 C.原子的最外層電子數為4 D.最高化合價為+6價 組卷:23引用:2難度:0.8 -
5.某主族元素的原子,M層上有一個半充滿的亞層(即該亞層的每個軌道只有1個電子),這種原子的質子數( )
A.只能是7 B.只能是15 C.是11或15 D.是11或13 組卷:31引用:7難度:0.9 -
6.基態碳原子的最外能層的各能級中,電子排布的方式正確的是( )
A. 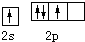
B. 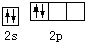
C. 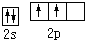
D. 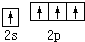 組卷:273引用:26難度:0.7
組卷:273引用:26難度:0.7 -
7.現有四種元素的基態原子的電子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5。則下列有關比較中正確的是( )
A.第一電離能:④>③>②>① B.原子半徑:④>③>②>① C.電負性:④>③>②>① D.最高正化合價:④>③=②>① 組卷:560引用:184難度:0.7
二、填空題:(本題包括6小題,共52分)
-
21.Q、R、X、Y、Z五種元素的原子序數依次遞增.已知:
①Z的原子序數為29,其余的均為短周期主族元素;
②Y原子價電子(外圍電子)排布為msnmpn;
③R原子核外L層電子數為奇數;
④Q、X原子p軌道的電子數分別為2和4.
請回答下列問題:
(1)Z2+的核外電子排布式是.
(2)Q與Y形成的最簡單氣態氫化物分別為甲、乙,下列判斷正確的是.
a.穩定性:甲>乙 b.穩定性:甲<乙
(3)Q、R、Y三種元素的第一電離能數值由小至大的順序為(用元素符號作答).
(4)五種元素中,電負性最大的元素是.組卷:11引用:4難度:0.5 -
22.1932年美國化學家鮑林首先提出了電負性的概念。電負性(用X表示)也是元素的一種重要性質,下表給出的是原子序數小于20的16種元素的電負性數值:
請仔細分析,回答下列有關問題:元素 H Li Be B C N O F 電負性 2.1 1.0 1.5 2.0 2.5 3.0 3.5 4.0 元素 Na Mg Al Si P S Cl K 電負性 0.9 1.2 1.5 1.7 2.1 2.3 3.0 0.8
(1)預測周期表中電負性最大的元素應為;估計鈣元素的電負性的取值范圍:<X<。
(2)經驗規律告訴我們:當形成化學鍵的兩原子相應元素的電負性差值大于1.7時,所形成的一般為離子鍵;當小于1.7時,一般為共價鍵。試推斷AlBr3中形成的化學鍵的類型為。
(3)請你預測Br與I元素的X數值的大小關系:X(Br)X(I)。
(4)某有機化合物分子中含有S-N鍵,你認為該共用電子對偏向于原子(填元素符號)。
(5)根據表中的所給數據分析:同主族內的不同元素的X值變化的規律是;
(6)化合物NaH能與水反應產生氫氣,所以可用做生氫劑,寫出該反應的化學方程式:。
(7)下列表述中,不能證明氯的非金屬性比硫強的是。
A.氣態氫化物的穩定性:HCl>H2S
B.兩元素的電負性:S<Cl
C.最高價含氧酸的酸性:HClO4>H2SO4
D.常溫時,硫單質為固態,氯單質為氣態
E.兩者間可發生反應:Cl2+H2S=2HCl+S↓組卷:27引用:2難度:0.7


