2019-2020學年安徽省黃山市屯溪一中高二(上)入學化學試卷
發布:2024/12/24 1:0:2
一、選擇題(共16小題,每小題3分,滿分48分)
-
1.下列說法中正確的是( )
A.硝酸鉀溶液能導電,所以硝酸鉀溶液是電解質 B.石墨有較好的導電性,所以石墨屬于電解質 C.液態氯化氫、固態氯化鈉均不能導電,所以氯化氫、氯化鈉均不是電解質 D.蔗糖在水溶液中和熔融狀態下均不能導電,所以蔗糖是非電解質 組卷:98引用:3難度:0.7 -
2.“春蠶到死絲方盡,蠟炬成灰淚始干”是唐代詩人李商隱的著名詩句,下列關于該詩句中所涉及物質的說法錯誤的是( )
A.蠶絲的主要成分是蛋白質 B.古代的蠟是高級脂肪酸酯,屬于高分子聚合物 C.蠶絲屬于天然高分子材料 D.“蠟炬成灰”過程中發生了氧化反應 組卷:268引用:45難度:0.8 -
3.下列有關化學鍵的說法中錯誤的是( )
A.氯化鈉熔化或氯化氫溶于水時都要破壞化學鍵 B.離子化合物中可能含有共價鍵,共價化合物中一定不含有離子鍵 C.氯化銨受熱變成氣體,冷卻后又成晶體,此過程中化學鍵沒有發生變化 D.碘晶體升華和冰融化時都未涉及化學鍵的變化 組卷:30引用:10難度:0.9 -
4.如圖是某另類元素周期表的一部分,下列說法正確的是( )

A.單質的氧化性:X>Y>Z B.簡單陰離子的半徑大小:X>Y>Z C.Y 只有一種氫化物 D.X 的最高價氧化物對應的水化物為強酸 組卷:60引用:4難度:0.6 -
5.NA為阿伏加德羅常數的值,下列敘述錯誤的是( )
A.1.8g H2O中含有的質子數為NA B.22.4L氯氣與足量鎂粉充分反應,轉移的電子數為2NA C.46g NO2和N2O4混合氣體中含有原子總數為3NA D.23g Na與足量O2反應,生成Na2O和Na2O2的混合物,鈉失去NA個電子 組卷:19引用:1難度:0.7 -
6.下列實驗現象與實驗操作不相匹配的是( )
實驗操作 實驗現象 A 向盛有高錳酸鉀酸性溶液的試管中通入足量的乙烯后靜置 溶液的紫色逐漸褪去,靜置后溶液分層 B 將鎂條點燃后迅速伸入集滿CO2的集氣瓶 集氣瓶中產生濃煙并有黑色顆粒產生 C 向盛有飽和硫代硫酸鈉溶液的試管中滴加稀鹽酸 有刺激性氣味氣體產生,溶液變渾濁 D 向盛有FeCl3溶液的試管中加過量鐵粉,充分振蕩后加1滴KSCN溶液 黃色逐漸消失,加KSCN后溶液顏色不變 A.A B.B C.C D.D 組卷:1559引用:12難度:0.6
二、填空題(共4小題,每小題12分,滿分52分)
-
19.海洋資源的利用具有廣闊前景。
(1)無需經過化學變化就能從海水中獲得的物質是(填序號)
A.Cl2 B.淡水 C.燒堿 D.食鹽
(2)圖是從海水中提取鎂的簡單流程。
①操作A是。
②海水提鎂的過程,為什么要將海水中的氯化鎂轉變為氫氧化鎂,再轉變為氯化鎂?。
(3)利用海底的“可燃冰”制作的酸性燃料電池的總反應式為:CH4+2O2=CO2+2H2O,則該燃料 電池負極的電極反應式為。
(4)海帶灰中富含以I-形式存在的碘元素,實驗室提取I2的途徑如圖所示:
①灼燒海帶至灰燼時所用的主要儀器是(填序號)。
a.坩堝 b.試管 c.蒸發皿 d.燒杯
②向酸化的濾液中加過氧化氫溶液,寫出該反應的離子方程式。
(5)海底的煤經綜合利用開發的副產物CO2能生產甲醇燃料,其反應的方程式為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某科學實驗將6mol CO2和8mol H2充入2L的密閉容器中,測得H2的物質的量隨時間變化如下圖實線所示 a,b,c,d 括號內數據表示坐標。
①a點正反應速率(填“大于、等于或小于”) a點逆反應速率。
②平衡時CO2的物質的量濃度是mol/L。
③能夠說明該反應達到化學平衡狀態的標志是。
A.單位時間內消耗1mol CO2,同時生成 3mol H2 B.混合氣體的密度不隨時間變化
C.CH3OH、H2的濃度不再隨時間變化 D.CH3OH和H2O濃度相等。組卷:7引用:1難度:0.6 -
20.綠礬是含有一定量結晶水的硫酸亞鐵,在工農業生產中具有重要的用途。某化學興趣小組對綠礬的一些性質進行探究。回答下列問題:
(1)在試管中加入少量綠礬樣品,加水溶解,滴加KSCN溶液,溶液顏色無明顯變化。再向試管中通入空氣,溶液逐漸變紅。由此可知:、。
(2)為測定綠礬中結晶水含量,將石英玻璃管(帶兩端開關K1和K2)(設為裝置A)稱重,記為m1 g.將樣品裝入石英玻璃管中,再次將裝置A稱重,記為 m2 g.按下圖連接好裝置進行實驗。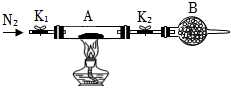
①儀器B的名稱是。
②將下列實驗操作步驟正確排序(填標號);重復上述操作步驟,直至A恒重,記為m3 g。
a.點燃酒精燈,加熱b。熄滅酒精燈c。關閉K1和K2
d.打開K1和K2,緩緩通入N2 e.稱量A f.冷卻至室溫
③根據實驗記錄,計算綠礬化學式中結晶水數目x=(列式表示)。若實驗時按a、d次序操作,則使x(填“偏大”“偏小”或“無影響”)。
(3)為探究硫酸亞鐵的分解產物,將(2)中已恒重的裝置A接入下圖所示的裝置中,打開K1和K2,緩緩通入N2,加熱。實驗后反應管中殘留固體為紅色粉末。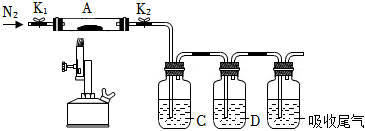
①C、D中的溶液依次為(填標號)。C、D中有氣泡冒出,并可觀察到的現象分別為。
a.品紅 b.NaOH c.BaCl2 d.Ba(NO3)2 e.濃H2SO4
②寫出硫酸亞鐵高溫分解反應的化學方程式。組卷:2054引用:21難度:0.5


