2020-2021學年河南省許昌市高二(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項正確,每小題3分)
-
1.下列合成纖維中吸濕性較好的是( )
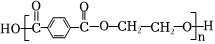
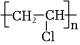
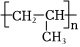
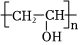
A.滌綸 B.氯綸 C.丙綸 D.維綸 A.A B.B C.C D.D 組卷:18引用:2難度:0.8 -
2.下列物質中,含有共價鍵的離子晶體是( )
A.I2 B.НСl C.NaBr D.KOH 組卷:4引用:2難度:0.7 -
3.氮化硼是一種新合成的結構材料,它是一種超硬、耐磨、耐高溫的物質.下列各組物質融化時,所克服的微粒間作用與氮化硼熔化時克服的微粒間作用都相同的是( )
A.硝酸鈉和金剛石 B.硅晶和水晶 C.冰和干冰 D.苯和萘 組卷:17引用:3難度:0.7 -
4.X、Y、Z三種元素的原子,其最外層電子排布分別為ns1、3s23p1和2s22p4,由這三種元素組成的化合物的化學式可能是( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3 組卷:272引用:47難度:0.9 -
5.反應A+B→C(放熱)分兩步進行:①A+B→X(吸熱),②X→C(放熱)。下列示意圖中,能正確表示總反應過程中能量變化的是( )
A. 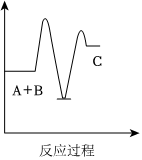
B. 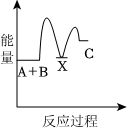
C. 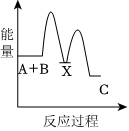
D. 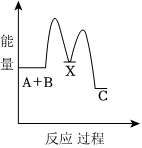 組卷:1032引用:62難度:0.9
組卷:1032引用:62難度:0.9 -
6.用下列實驗裝置進行的實驗,不能達到相應實驗目的的是( )
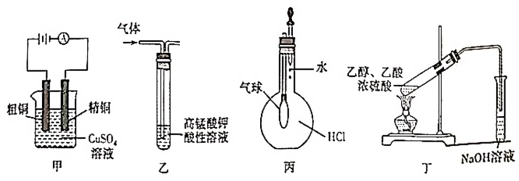
A.裝置甲銅的精煉 B.裝置乙檢驗乙烷中混有乙烯 C.裝置丙驗證HCl氣體在水中的溶解性 D.裝置丁實驗室制取并收集乙酸乙酯 組卷:2引用:1難度:0.5 -
7.分子式為 C9H12 的所有帶苯環結構的異構體中,在催化劑條件下與液溴發生取代反應,其一溴代物 為三種的結構有( )
A.1 種 B.2 種 C.3 種 D.4 種 組卷:77引用:3難度:0.7
三、(本題包括2個小題,共28分)
-
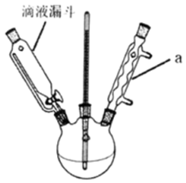 21.硝基苯是一種重要的化工原料,實驗室在55℃~60℃的條件下將20mL的苯(密度為0.88g/cm3)與22mL濃硫酸和20mL濃硝酸的混合液共熱來制備硝基苯(難溶于水的油狀液體),制備原理和裝置示意圖(加熱和夾持裝置省略)如下:
21.硝基苯是一種重要的化工原料,實驗室在55℃~60℃的條件下將20mL的苯(密度為0.88g/cm3)與22mL濃硫酸和20mL濃硝酸的混合液共熱來制備硝基苯(難溶于水的油狀液體),制備原理和裝置示意圖(加熱和夾持裝置省略)如下: +HNO3濃硫酸△
+HNO3濃硫酸△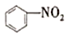 +H2O
+H2O
查閱資料可知反應機理如下:
①HNO3+2H2SO4?H3O+++O2+2HSO4-+N
② ++NO2→
++NO2→
③?。
回答下列問題:
(1)中間產物O2的分子構型是+N。
(2)中間體正離子( )中與硝基相連的碳原子的雜化方式是 。上述第③步反應的方程式為。
)中與硝基相連的碳原子的雜化方式是 。上述第③步反應的方程式為。
(3)為了很好的控制該實驗反應溫度,可采用加熱的方法。儀器a的名稱是。恒壓滴液漏斗與普通滴液漏斗相比,優點是。混合濃硫酸和濃硝酸的操作是往裝有濃硝酸的燒杯中加入濃硫酸并不斷攪拌。不斷攪拌的目的是。
(4)反應結束后,冷卻反應混合物,分離出有機層,所得物質中除硝基苯外還含有硝酸、硫酸、苯等。依次用蒸餾水、5%的NaOH溶液和蒸餾水洗滌,再用無水CaCl2干燥后得到粗硝基苯。有機層選用5%的NaOH溶液洗滌是因為。第一次用蒸餾水洗滌的主要目的是。
(5)實驗所用苯的質量為。若該實驗制備得到純硝基苯18g,則該實驗依據苯的用量,計算的硝基苯產率是。(保留小數點后兩位)組卷:9引用:1難度:0.5 -
 22.目前,消除二氧化硫(SO2)和氮氧化物(NOx)對大氣污染有多種方法。
22.目前,消除二氧化硫(SO2)和氮氧化物(NOx)對大氣污染有多種方法。
(1)處理NOx的一種方法是利用氨氣還原法將NOx還原為N2和H2O(g)。已知還原1mol NO約放出451.7kJ的熱量,則該反應的熱化學方程式為。
(2)全釩氧化還原液流電池,是優秀綠色環保儲能電池。其電池總反應為:V3++VO2++H2OVO2++2H++V2+。放電過程中,H+向充電放電遷移(填“正極區”或“負極區”),其正極反應式為。充電時陰極反應式為。
(3)降低汽車尾氣的方法之一是在排氣管上安裝催化轉化器,發生如下反應
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0。
①該反應的化學平衡常數表達式為K=。
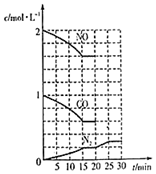
②若在一定溫度下,將2mol NO,1mol CO充入1L固定容積的容器中,反應過程中各物質的濃度變化如圖所示。則前20min內用CO2的濃度變化表示的反應平均速率為。
③20min時,若改變反應條件,導致N2濃度發生如圖所示的變化,則改變的條件可能是(填序號)。
A.加入催化劑
B.降低溫度
C.縮小容器體積
D.增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常溫下將SO2轉化SO42-而實現SO2的處理(總反應為2SO2+O2+2H2O═2H2SO4)。已知,含SO2的廢氣通入含Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2++O2+4H+═4Fe3++2H2O,則另一反應的離子方程式為。組卷:2引用:1難度:0.4


