2020-2021學年安徽省合肥市新東方學校高二(下)月考化學試卷0018
發布:2025/1/6 7:30:2
一、選擇題(共18題,每題3分,共計54分)
-
1.在某一元酸的下列性質中,可以證明它是弱電解質的是( )
A.1mol/L的某一元酸溶液中c(H+)約為1×10-2mol/L B.某一元酸能與水以任意比例互溶 C.1mol/L的某一元酸溶液10mL恰好與10mL 1mol/L的NaOH溶液完全反應 D.在相同條件下,某一元酸溶液的導電性比硫酸弱 組卷:44引用:4難度:0.6 -
2.下列水溶液一定呈中性的是( )
A.c(NH4+)=c(Cl-)的NH4Cl溶液 B.c(H+)=1×10-7mol?L-1的溶液 C.pH=7的溶液 D.室溫下將pH=3的酸與pH=11的堿等體積混合后的溶液 組卷:7引用:4難度:0.6 -
3.從植物花汁中提取的一種有機物HIn,可做酸、堿指示劑,在水溶液中存在電離平衡:HIn(紅色)?H++In-(黃色),對上述平衡解釋不正確的是( )
A.升高溫度平衡向正方向移動 B.加入鹽酸后平衡向逆方向移動,溶液顯紅色 C.加入NaOH溶液后平衡向正方向移動,溶液顯黃色 D.加入NaHSO4溶液后平衡向正方向移動,溶液顯黃色 組卷:82引用:23難度:0.9 -
4.常溫下,下列三種溶液中,由水電離出的氫離子濃度之比為( )
①1mol/L的鹽酸②0.1mol/L的鹽酸③0.01mol/L的NaOH.A.1:10:100 B.0:1:12 C.14:13:12 D.14:13:2 組卷:150引用:10難度:0.7 -
 5.如圖表示溶液中c(H+)和c(OH-)的關系,下列判斷錯誤的是( )
5.如圖表示溶液中c(H+)和c(OH-)的關系,下列判斷錯誤的是( )A.兩條曲線間任意點均有c(H+)×c(OH-)=Kw B.M區域內任意點均有c(H+)<c(OH-) C.圖中T1<T2 D.XZ線上任意點均有pH=7 組卷:2587引用:39難度:0.7 -
6.今有室溫下四種溶液,有關敘述不正確的是( )
序號 ① ② ③ ④ pH 11 11 3 3 溶液 氨水 氫氧化鈉溶液 醋酸 鹽酸 A.①、②中分別加入適量的氯化銨晶體后,兩溶液的pH均減小 B.分別加水稀釋10倍,四種溶液的pH:①>②>④>③ C.①、④兩溶液等體積混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.V1L④與V2L②溶液混合后,若混合后溶液pH=4,則V1:V2=11:9 組卷:25引用:1難度:0.6 -
7.常溫下,下列敘述正確的是( )
A.pH等于5的HCl溶液和pH等于9的NaOH溶液中由水電離出的c(H+)之比為1:1 B.兩種CH3COOH溶液的物質的量濃度分別為c1和c2,pH分別為a和a+1,則c1=10c2 C.pH=2的HNO3溶液和pH=10的Ba(OH)2溶液等體積混合后所得溶液的pH=7 D.向0.1mol/L 的氨水中加入少量醋酸銨固體,則溶液中c(OH-)/c(NH3?H2O)增大 組卷:17引用:2難度:0.7
二、主觀題(共46分)
-
21.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用毒重石制備BaCl2?2H2O的流程如圖:
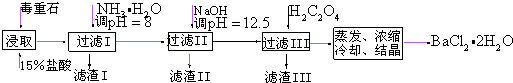
(1)毒重石用鹽酸浸取前需充分研磨,目的是.實驗室用37%的鹽酸配制15%的鹽酸,除量筒外還需使用下列儀器中的.
a.燒杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
加入NH3?H2O調節pH=8可除去Ca2+ Mg2+ Fe3+ 開始沉淀時的pH 11.9 9.1 1.9 完全沉淀時的pH 13.9 11.1 3.2 (填離子符號),濾渣Ⅱ中含(填化學式).加入H2C2O4時應避免過量,原因是.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(Ca C2O4)=2.3×10-9
(3)利用間接酸堿滴定法可測定Ba2+的含量,實驗分兩步進行.
已知:2+2H+═Cr2CrO2-4+H2O Ba2++O2-7═BaCrO4↓CrO2-4
步驟Ⅰ移取xml一定濃度的Na2CrO溶液與錐形瓶中,加入酸堿指示劑,用b mol?L-1鹽酸標準液滴定至終點,測得滴加鹽酸體積為V0mL.
步驟Ⅱ:移取y mLBaCl2溶液于錐形瓶中,加入x mL與步驟Ⅰ相同濃度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸堿指示劑,用b mol?L-1鹽酸標準液滴定至終點,測得滴加鹽酸的體積為V1mL.滴加鹽酸標準液時應用酸式滴定管,“0”刻度位于滴定管的(填“上方”或“下方”).BaCl2溶液的濃度為mol?L-1,若步驟Ⅱ中滴加鹽酸時有少量待測液濺出,Ba2+濃度測量值將(填“偏大”或“偏小”).組卷:118引用:5難度:0.5 -
22.科學家預言,燃料電池將是21世紀獲得電力的重要途徑.一種氫氧燃料電池是采用鉑作電極,以氫氧化鉀為電解液,一個電極通入氫氣,同時向一個電極通入空氣.試回答下列問題:
(1)這種電池放電時發生的化學反應方程式是.
(2)此電池的正極發生的電極反應是;負極發生的電極反應是.
(3)電解液中的H+離子向極移動;向外電路釋放電子的電極是.組卷:9引用:1難度:0.9


