2021年北京市高考化學(xué)試卷(等級性)
發(fā)布:2024/4/20 14:35:0
本部分共14題,每題3分,共42分。在每題列出的四個選項(xiàng)中,選出最符合題目要求的一項(xiàng)。
-
 1.我國科研人員發(fā)現(xiàn)中藥成分黃芩素能明顯抑制新冠病毒的活性。下列有關(guān)黃芩素的說法不正確的是( )
1.我國科研人員發(fā)現(xiàn)中藥成分黃芩素能明顯抑制新冠病毒的活性。下列有關(guān)黃芩素的說法不正確的是( )A.分子中有3種官能團(tuán) B.能與Na2CO3溶液反應(yīng) C.在空氣中可發(fā)生氧化反應(yīng) D.能與Br2發(fā)生取代反應(yīng)和加成反應(yīng) 組卷:702引用:7難度:0.5 -
2.下列有關(guān)放射性核素氚(
H)的表述不正確的是( )31A. H原子核外電子數(shù)為131B. H原子核內(nèi)中子數(shù)為331C. H2與H2化學(xué)性質(zhì)基本相同31D. H2O具有放射性31組卷:423引用:4難度:0.8 -
3.下列化學(xué)用語或圖示表達(dá)不正確的是( )
A.N2的結(jié)構(gòu)式:N≡N B.Na+的結(jié)構(gòu)示意圖: 
C.溴乙烷的分子模型: 
D.CO2的電子式:  組卷:390引用:10難度:0.4
組卷:390引用:10難度:0.4 -
4.下列性質(zhì)的比較,不能用元素周期律解釋的是( )
A.酸性:HClO4>H2SO3>H2SiO3 B.堿性:KOH>NaOH>LiOH C.熱穩(wěn)定性:H2O>H2S>PH3 D.非金屬性:F>O>N 組卷:577引用:19難度:0.6 -
5.實(shí)驗(yàn)室制備下列氣體所選試劑、制備裝置及收集方法均正確的是( )
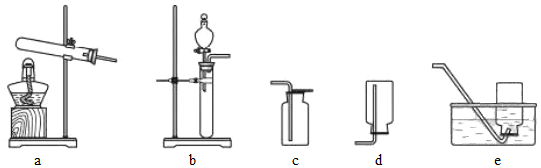
氣體 試劑 制備裝置 收集方法 A O2 KMnO4 a d B H2 Zn+稀H2SO4 b e C NO Cu+稀HNO3 b c D CO2 石灰石+稀H2SO4 b c A.A B.B C.C D.D 組卷:493引用:5難度:0.7 -
 6.室溫下,1體積的水能溶解約40體積的SO2。用試管收集SO2后進(jìn)行如下實(shí)驗(yàn)。對實(shí)驗(yàn)現(xiàn)象的分析正確的是( )
6.室溫下,1體積的水能溶解約40體積的SO2。用試管收集SO2后進(jìn)行如下實(shí)驗(yàn)。對實(shí)驗(yàn)現(xiàn)象的分析正確的是( )A.試管內(nèi)液面上升,證明SO2與H2O發(fā)生了反應(yīng) B.試管中剩余少量氣體,是因?yàn)镾O2的溶解已達(dá)飽和 C.取出試管中溶液,立即加入紫色石蕊試液,溶液顯紅色,原因是:SO2+H2O?H2SO3,H2SO3?H++ ,HSO-3?H++HSO-3SO2-3D.取出試管中溶液,在空氣中放置一段時間后pH下降,是由于SO2揮發(fā) 組卷:664引用:19難度:0.7
本部分共5題,滿分58分。
-
18.鐵黃是一種重要的化工產(chǎn)品。由生產(chǎn)鈦白粉廢渣制備鐵黃的過程如下。

資料:ⅰ.鈦白粉廢渣成分:主要為FeSO4?H2O,含少量TiOSO4和不溶物
ⅱ.TiOSO4+(x+1)H2O?TiO2?xH2O↓+H2SO4
ⅲ.0.1mol?L-1 Fe2+生成Fe(OH)2,開始沉淀時pH=6.3,完全沉淀時pH=8.3
0.1mol?L-1 Fe3+生成FeOOH,開始沉淀時pH=1.5,完全沉淀時pH=2.8
(1)純化
①加入過量鐵粉的目的是。
②充分反應(yīng)后,分離混合物的方法是。
(2)制備晶種
為制備高品質(zhì)鐵黃產(chǎn)品,需先制備少量鐵黃晶種。過程及現(xiàn)象是:向一定濃度FeSO4溶液中加入氨水,產(chǎn)生白色沉淀,并很快變成灰綠色。滴加氨水至pH為6.0時開始通空氣并記錄pH變化(如圖)。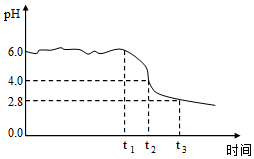
①產(chǎn)生白色沉淀的離子方程式是。
②產(chǎn)生白色沉淀后的pH低于資料ⅲ中的6.3。原因是:沉淀生成后c(Fe2+)0.1mol?L-1(填“>”“=”或“<”)。
③0-t1時段,pH幾乎不變;t1-t2時段,pH明顯降低。結(jié)合方程式解釋原因:。
④pH≈4時制得鐵黃晶種。若繼續(xù)通入空氣,t3后pH幾乎不變,此時溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+ )降低量大于c(Fe3+ )增加量。結(jié)合總方程式說明原因:。
(3)產(chǎn)品純度測定
鐵黃純度可以通過產(chǎn)品的耗酸量確定。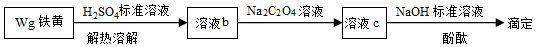
資料:Fe3++3C2═Fe(C2O4)33-,F(xiàn)e(C2O4)33-不與稀堿液反應(yīng)Na2C2O4過量,會使測定結(jié)果O2-4(填“偏大”“偏小”或“不受影響”)。組卷:586引用:3難度:0.5 -
19.某小組探究鹵素參與的氧化還原反應(yīng),從電極反應(yīng)角度分析物質(zhì)氧化性和還原性的變化規(guī)律。
(1)濃鹽酸與MnO2混合加熱生成氯氣。氯氣不再逸出時,固液混合物A中仍存在鹽酸和MnO2。
①反應(yīng)的離子方程式是。
②電極反應(yīng)式:
ⅰ.還原反應(yīng):MnO2+2e-+4H+═Mn2++2H2O
ⅱ.氧化反應(yīng):
③根據(jù)電極反應(yīng)式,分析A中仍存在鹽酸和MnO2的原因。
ⅰ.隨c(H+)降低或c(Mn2+)升高,MnO2氧化性減弱。
ⅱ.隨c(Cl-)降低,。
④補(bǔ)充實(shí)驗(yàn)證實(shí)了③中的分析。
a是序號 實(shí)驗(yàn) 加入試劑 現(xiàn)象 Ⅰ 
較濃硫酸 有氯氣 Ⅱ a 有氯氣 Ⅲ a和b 無氯氣 ,b是。
(2)利用c(H+)對MnO2氧化性的影響,探究鹵素離子的還原性。相同濃度的KCl、KBr和KI溶液,能與MnO2反應(yīng)所需的最低c(H+)由大到小的順序是,從原子結(jié)構(gòu)角度說明理由。
(3)根據(jù)(1)中結(jié)論推測:酸性條件下,加入某種化合物可以提高溴的氧化性,將Mn2+氧化為MnO2。經(jīng)實(shí)驗(yàn)證實(shí)了推測。該化合物是。
(4)Ag分別與1 mol?L-1的鹽酸、氫溴酸和氫碘酸混合,Ag只與氫碘酸發(fā)生置換反應(yīng)。試解釋原因:。
(5)總結(jié):物質(zhì)氧化性和還原性變化的一般規(guī)律是。組卷:767引用:6難度:0.5


