2022-2023學年天津市扶輪中學高三(上)期末化學試卷
發布:2024/12/28 13:30:3
一、選擇題(每題只有一個正確選項,每題3分,共36分)
-
1.近年來我國取得讓世界矚目的科技成果,化學功不可沒。下列說法不正確的是( )
A.“天和核心艙”電推進系統中的腔體采用氮化硼陶瓷屬于有機物 B.“北斗系統”組網成功,北斗芯片中的半導體材料為硅 C.“嫦娥五號”運載火箭用液氧液氫推進劑,產物對環境無污染 D.“奮斗者”號潛水器外殼材料為鈦合金,22號鈦元素屬于過渡元素 組卷:92引用:6難度:0.7 -
2.下列說法錯誤的是( )
A.淀粉和纖維素均可水解產生葡萄糖 B.油脂的水解反應可用于生產甘油 C.氨基酸是組成蛋白質的基本結構單元 D.淀粉、纖維素和油脂均是天然高分子 組卷:874引用:19難度:0.7 -
3.下列實驗設計不能達到實驗目的的是( )
實驗目的 實驗設計 A 檢驗溶液中FeSO4是否被氧化 取少量待測液,滴加KSCN溶液,觀察溶液顏色變化 B 凈化實驗室制備的Cl2 氣體依次通過盛有飽和NaCl溶液、濃H2SO4的洗氣瓶 C 測定NaOH溶液的pH 將待測液滴在濕潤的pH試紙上,與標準比色卡對照 D 工業酒精制備無水乙醇 工業酒精中加生石灰,蒸餾 A.A B.B C.C D.D 組卷:511引用:10難度:0.5 -
4.核聚變發電有望成為解決人類能源問題的重要手段之一,氘(
H)是核聚變反應的主要原料,下列有關敘述正確的是( )21A. H的中子數為221B. H的核電荷數為121C. H是自然界中最輕的原子21D. H是氫元素的一種同素異形體21組卷:563引用:5難度:0.8 -
5.下列有關物質性質的比較,結論正確的是( )
A.溶解度:Na2CO3<NaHCO3 B.熱穩定性:HCl<PH3 C.第一電離能:O<N D.堿性:LiOH<Be(OH)2 組卷:44引用:1難度:0.7
四、實驗題
-
15.H2O2作為綠色氧化劑應用廣泛,氫醌法制備H2O2原理及裝置如圖:
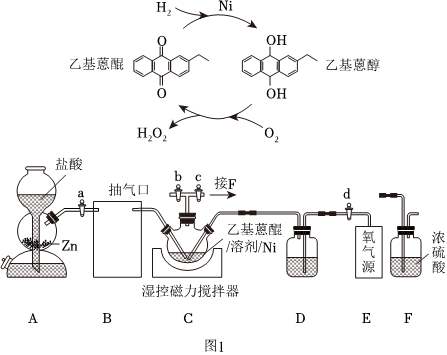
已知:H2O、HX等雜質易使Ni催化劑中毒。回答下列問題:
(1)A中反應的離子方程式為。
(2)如圖2所示,裝置B應為(填序號)。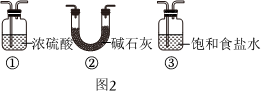
(3)檢查裝置氣密性并加入藥品,所有活塞處于關閉狀態。開始制備時,打開活塞,控溫45℃。一段時間后,僅保持活塞b打開,抽出殘留氣體。隨后關閉活塞b,打開活塞,繼續反應一段時間。關閉電源和活塞,過濾三頸燒瓶中混合物,加水萃取,分液,減壓蒸餾,得產品。
(4)裝置F的作用為。
(5)反應過程中,控溫45℃的原因為。
(6)氫醌法制備H2O2總反應的化學方程式為。
(7)取2.50g產品,加蒸餾水定容至100mL搖勻。取20.00mL于錐形瓶中,用0.0500mol?L-1酸性KMnO4標準溶液滴定。平行滴定三次,消耗標準溶液體積分別為19.98mL、20.90mL、20.02mL。假設其他雜質不干擾結果,產品中H2O2質量分數為。組卷:45引用:6難度:0.5
五、原理綜合題
-
 16.利用CO或CO2和H2反應都可以制取甲醇。
16.利用CO或CO2和H2反應都可以制取甲醇。
(1)已知:CO2(g)+H2(g)?CO(g)+H2O(g) ΔH1=+41kJ?mol-1
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH2=-49kJ?mol-1
則反應CO(g)+2H2(g)?CH3OH(g) ΔH=。可以在進行(填序號)。
A.高溫自發
B.低溫自發
C.高、低溫均能自發
D.高、低溫均不自發
(2)利用反應CO(g)+2H2(g)?CH3OH(g) ΔH合成甲醇。T°C時向固定容積的密閉容器中充入CO、H2,反應到t時刻測得各組分的濃度如下:
①如果該反應的平衡常數K=160,比較t時刻正、逆反應速率的大小:v正物質 H2 CO CH3OH 濃度/mol?L-1 0.20 0.10 0.40 v逆(填“>”、“<”或“=”)。
②要提高CO的轉化率,可以采取的措施是(填序號)。
A.加入催化劑
B.增大CO的濃度
C.通入惰性氣體
D.通入H2
E.分離出甲醇
(3)T℃時,向恒容密閉容器中充入CO2和H2,發生反應:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH
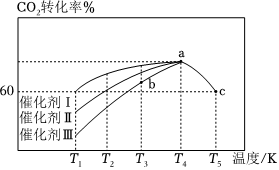
①如果CO2和H2的起始濃度分別為amol?L-1和3amol?L-1,反應平衡時CO2的轉化率為b,則該溫度下該反應的平衡常數K=(用含a、b的表達式表示)。
②在使用不同催化劑時,相同時間內測得CO2的轉化率隨溫度的變化如圖所示。則催化效果最佳的是催化劑(填“Ⅰ”、“Ⅱ”或“Ⅲ”)。如果a點已經達到平衡狀態,則b點的v正v逆(填“>”、“<”或“=”),c點轉化率比a點低的原因是。組卷:58引用:2難度:0.7


