2021-2022學年黑龍江省雙鴨山一中高二(上)第一次月考化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每個只有一個正確答案,1-20題每題2分,21-25題每題3分,共55)
-
1.被稱為人體冷凍學之父的羅伯特?埃廷格在1962年寫出《不朽的前景》一書。他在書中列舉了大量事實,證明了冷凍復活的可能。比如,許多昆蟲和低等生物冬天都凍僵起來,春天又自動復活。下列結論中與上述信息相關的是( )
A.化學反應前后質量守恒 B.低溫下分子無法運動 C.溫度降低,化學反應停止 D.溫度越低,化學反應越慢 組卷:50引用:4難度:0.9 -
2.下列有關化學反應速率的說法中,正確的是( )
A.100 mL 2 mol?L-1的鹽酸與鋅反應時,加入適量的NaCl溶液,生成H2的速率不變 B.用鐵片和稀硫酸反應制取H2時,改用鐵片和濃硫酸可以加快產生H2的速率 C.二氧化硫的催化氧化反應是一個放熱反應,所以升高溫度,反應速率減慢 D.汽車尾氣中的CO和NO可以緩慢反應生成N2和CO2,增大壓強,反應速率加快 組卷:18引用:3難度:0.6 -
3.下列不能用勒夏特列原理解釋的事實是( )
A.氯水中有下列平衡:Cl2+H2O?HCl+HClO,光照后氯水顏色變淺 B.合成氨工業(yè)使用高壓以提高氨的產量 C.對于H2(g)+I2(g)?2HI(g),達平衡后,縮小容器體積可使體系顏色變深 D.汽水型飲料打開瓶蓋后產生大量氣體 組卷:13引用:2難度:0.5 -
4.下列說法正確的是( )
A.增大壓強,因為增大了活化分子百分數(shù),所以化學反應速率加快 B.能夠發(fā)生有效碰撞的分子叫做活化分子 C.反應物用量增加后,有效碰撞次數(shù)增多,反應速率增大 D.催化劑能提高活化分子的活化能,從而加快反應速率 組卷:12引用:2難度:0.7 -
5.根據以下三個熱化學方程式:
①2H2S(g)+3O2(g)→2SO2(g)+2H2O(l)△H1=-akJ;
②2H2S(g)+O2(g)→2S(s)+2H2O(l)△H2=-bkJ
③2H2S(g)+O2(g)→2S(s)+2H2O(g)△H3=-ckJ(a、b、c均為正數(shù))
對a、b、c三者大小關系的判斷正確的是( )A.a>c>b B.c>b>a C.a>b>c D.b>a>c 組卷:120引用:2難度:0.5 -
6.下列關于能量判據和熵判據的說法中,不正確的是( )
A.放熱的自發(fā)過程可能是熵減小的過程,吸熱的自發(fā)過程一定為熵增加的過程 B.由能量判據和熵判據組合成的復合判據,將更適合于所有的過程 C.在室溫下碳酸鈣的分解反應不能自發(fā)進行,但同樣是這個吸熱反應在較高溫度(1200 K)下則能自發(fā)進行 D.放熱過程(△H<0)或熵增加(△S>0)的過程一定是自發(fā)的 組卷:93引用:21難度:0.9 -
7.對反應A+B=AB來說,常溫下按以下情況進行反應:
①20mL溶液中含A、B各0.01mol
②50mL溶液中含A、B各0.05mol
③0.1mol?L-1的A、B溶液各10mL
④0.3mol?L-1的A、B溶液各50mL
四者反應速率大小關系是( )A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④ 組卷:55引用:6難度:0.6 -
8.反應CO(g)+2H2(g)?CH3OH(g)ΔH<0達到平衡后,只改變一個反應條件,下列所畫示意圖不正確的是( )
A. 
B. 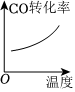
C. 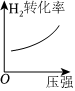
D. 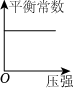 組卷:34引用:4難度:0.5
組卷:34引用:4難度:0.5 -
9.下列說法正確的是( )
A.H2(g)的燃燒熱△H=-285.8kJ?mol-1,則2H2O(g)═2H2(g)+O2(g)△H=+571.6kJ?mol-1 B.已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,則稀醋酸與稀氫氧化鈉溶液反應生成1mol水時放出57.3kJ的熱量 C.C(g)+ O2(g)═CO(g)△H=-110.52kJ?mol-1,則碳的燃燒熱△H=-110.52kJ?mol-112D.C(石墨,s)═C(金剛石,s)△H>0,說明石墨比金剛石穩(wěn)定 組卷:31引用:6難度:0.9 -
10.低溫脫氮技術可用于處理廢棄中的氮氧化物。發(fā)生的化學反應為:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)+Q。在恒容密閉容器中,下列說法正確的是( )
A.該反應是放熱反應,降低溫度將縮短反應達到平衡的時間 B.其他條件不變,使用高效催化劑,可以提高處理效率 C.4mol氨氣與足量的NO充分反應,放出的熱量為Q D.增大壓強,正反應速率增大逆反應速率減少,平衡逆向移動 組卷:13引用:1難度:0.7
二、填空(共45分)
-
30.工業(yè)上合成氨的反應:N2(g)+3H2(g)?2NH3(g)△H=-92.60kJ?mol-1。
已知合成氨反應在某溫度下2L的密閉容器中進行,測得如表數(shù)據:
根據表中數(shù)據計算:時間(h)
物質的量(mol)0 1 2 3 4 N2 1.50 n1 1.20 n3 1.00 H2 4.50 4.20 3.60 n4 3.00 NH3 0 0.20 1.00 1.00
(1)反應進行到2h時放出的熱量為kJ。
(2)0~1h內N2的平均反應速率為mol?L-1?h-1。
(3)此溫度下該反應的化學平衡常數(shù)K=(保留兩位小數(shù))。
(4)反應達到平衡后,若往平衡體系中再加入N2、H2和NH3各1.00mol,化學平衡將向方向移動(填“正反應”或“逆反應”),理由。
(5)要縮短達到平衡的時間,可采取的措施有、(寫兩條即可)。
(6)下列說法正確的是。
A.該反應實際生產中的高溫是為了加快反應速率和提高反應正向進行的程度
B.在恒溫恒容密閉容器中,投入等物質的量N2和H2,在一定條件下反應,當N2體積分數(shù)不變時,體系達化學平衡狀態(tài)
C.合成氨時需要除去原料氣中的CO,防止催化劑中毒
D.在工業(yè)生產過程中,不斷將氨液化并移去液氨以提高原料的利用率組卷:11引用:2難度:0.5 -
31.工業(yè)燃燒煤、石油等化石燃料釋放出大量氮氧化物(NOx)、CO2、SO2等氣體,嚴重污染空氣。對廢氣進行脫硝、脫碳和脫硫處理可實現(xiàn)綠色環(huán)保、廢物利用。
脫碳:向2L密閉容器中加入2molCO2和6molH2,在適當?shù)拇呋瘎┳饔孟掳l(fā)生反應:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H<0
(1)下列敘述能說明此反應達到平衡狀態(tài)的是。
A.混合氣體的平均相對分子質量保持不變
B.CO2和H2的體積分數(shù)保持不變
C.CO2和H2的轉化率相等
D.混合氣體的密度保持不變
E.1molCO2生成的同時有3molH-H鍵斷裂
(2)改變溫度,使反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH<0中的所有物質都為氣態(tài)。該反應的速率隨時間(0~t2)變化如圖所示,在t2時將容器容積縮小一倍,t3時達到平衡,t4時降低溫度,t5時達到平衡,請畫出t2~t6反應速率隨時間的變化曲線并標出正逆反應速率。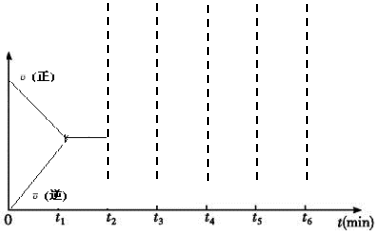
(3)根據有關圖像,說法正確的是。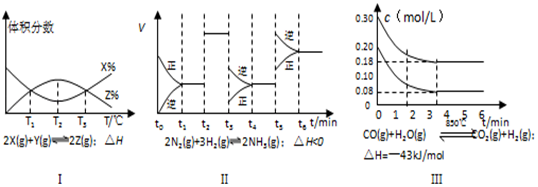
A.由圖Ⅰ知,反應在T1、T3處達到平衡,且該反應的△H<0
B.由圖Ⅱ知,反應在t6時,NH3體積分數(shù)最大
C.由圖Ⅱ知,t3時采取降低反應溫度的措施
D.Ⅲ在10L容器、850℃時反應,由圖知,到4min時,反應放出51.6kJ的熱量
(4)反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH<0 起始溫度、體積相同(T1℃、2L密閉容器)。反應過程中部分數(shù)據見表:
達到平衡時,反應Ⅰ、Ⅱ、Ⅲ平衡常數(shù)K(Ⅰ)、K(Ⅱ)、K(Ⅲ)的大小關系反應條件 反應時間 CO2(mol) H2(mol) CH3OH(mol) H2O(mol) 反應Ⅰ:恒溫恒容 0min 2 6 0 0 反應Ⅱ:絕熱恒容 0min 0 0 2 2 反應Ⅲ:恒溫恒壓 0min 2 6 0 0 (填“>”“<”或“=”),對反應Ⅰ和Ⅲ,CO2的平衡轉化率α(Ⅰ)α(Ⅲ) (填“>”“<”或“=”),
反應Ⅰ和Ⅱ,CH3OH平衡時的體積分數(shù)w(Ⅰ)w(Ⅱ) (填“>”“<”或“=”)。組卷:7引用:1難度:0.4


