2022-2023學年北京市豐臺區九年級(上)期末化學試卷
發布:2024/12/22 3:0:2
一、本部分共25題,每小題1分,在每小題列出的選項中,選出符合題目要求的一項。
-
1.空氣中氧氣的體積分數約為( )
A.78% B.21% C.0.94% D.0.03% 組卷:205引用:41難度:0.9 -
2.下列元素的符號書寫不正確的是( )
A.碳 C B.氯 Cl C.鉀 K D.銅 CU 組卷:137引用:9難度:0.9 -
3.食用瘦肉、蛋、魚等可以補鐵.這里的“鐵”指的是( )
A.分子 B.原子 C.元素 D.單質 組卷:21引用:14難度:0.9 -
4.下列物質的性質中,屬于化學性質的是( )
A.無色無味 B.沸點低 C.能支持燃燒 D.不易溶于水 組卷:40引用:3難度:0.8 -
5.下列物質中,屬于純凈物的是( )
A.氮氣 B.海水 C.空氣 D.石灰石 組卷:32引用:4難度:0.8 -
6.下列物質中不會造成空氣污染的是( )
A.可吸入顆粒物 B.二氧化氮 C.二氧化硫 D.氮氣 組卷:55引用:3難度:0.7 -
7.碳元素和氧元素的本質區別是( )
A.中子數不同 B.電子數不同 C.質子數不同 D.相對原子質量不同 組卷:52引用:3難度:0.7 -
8.化石燃料是不可再生的能源.下列不屬于化石燃料的是( )
A.煤 B.石油 C.乙醇 D.天然氣 組卷:152引用:74難度:0.9 -
9.下列符號中,表示兩個氧原子的是( )
A.O2 B.2O C.O2- D.2O2 組卷:301引用:22難度:0.6 -
10.下列物質的用途對應不正確的是( )
A.金剛石用于裁玻璃 B.氮氣用于食品防腐 C.干冰用于人工降雨 D.氧氣用于滅火 組卷:10引用:3難度:0.7 -
11.下列物質中,含有金屬元素的是( )
A.Al2O3 B.P2O5 C.NO2 D.H2SO4 組卷:156引用:5難度:0.8 -
12.下列圖標中,表示“禁止煙火”的是( )
A. 
B. 
C. 
D.  組卷:61引用:13難度:0.8
組卷:61引用:13難度:0.8
〖科學探究〗
-
37.實驗小組對蠟燭燃燒進行探究。
探究Ⅰ、蠟燭在密閉容器中熄滅的原因。
【進行實驗】利用傳感器測量密閉容器中點燃蠟燭至熄滅時,O2、CO2含量(體積分數)的變化。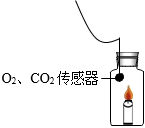
探究Ⅱ、影響蠟燭燃燒速率的因素。O2含量 CO2含量 蠟燭點燃前 20.7% 0.058% 蠟燭熄滅后 15.9% 3.6%
取起始燭芯高度相同,蠟燭直徑、燭芯棉線股數不同的蠟燭在空氣中點燃,測定每小時蠟燭燃燒減少的質量。實驗記錄如下:
【解釋與結論】實驗序號 蠟燭直徑/cm 燭芯棉線股數/股 每小時蠟燭燃燒減少質量/g ① 2 32 11.5 ② 4 32 4.97 ③ 6 18 3.04 ④ 6 25 3.29 ⑤ 6 32 3.77 ⑥ 6 42 5.10
(1)蠟燭在密閉容器中燃燒后CO2含量增大,由此可推測蠟燭中一定含有的元素是。
(2)同學們收集一瓶V(O2):V(CO2)=1:4的混合氣體,放入點燃的蠟燭,觀察到蠟燭能繼續燃燒。說明探究Ⅰ中蠟燭在密閉容器中燃燒一段時間后熄滅的原因是(填字母序號)。
A.O2濃度過低
B.CO2濃度過高
(3)探究Ⅱ,實驗①中蠟燭燃燒每小時減少的質量比實驗②高的原因是。
(4)依據實驗③~⑥得出的結論是。
(5)探究蠟燭直徑對蠟燭燃燒速率影響的實驗是(填序號)。
【反思與評價】
(6)依據上述實驗,除了燭芯棉線股數和蠟燭直徑,影響蠟燭燃燒速率的因素還可能是(寫出一條即可)。組卷:81引用:1難度:0.6
〖生產實際定量分析〗
-
38.一種鎂合金可制成發熱包。使用時加入水即可與鎂反應,同時放出大量的熱。Mg+2H2O=Mg(OH)2+H2↑,計算:4.8g鎂完全反應,理論上至少需要水的質量
(寫出計算過程及結果)。組卷:105引用:6難度:0.6


