2021-2022學年陜西省漢中中學高二(上)期末化學試卷(理科)
發布:2024/4/20 14:35:0
一、選擇題(本題包括14小題,每小題3分,共42分。每小題只有一個選項符合題意。)
-
1.下列關于常見物質的工業冶煉說法正確的是( )
A.工業制金屬鈉:電解飽和食鹽水 B.工業上用氯氣和澄清石灰水為原料制漂白粉 C.冶煉鎂:將六水合氯化鎂晶體在一定條件下加熱得到無水氯化鎂,電解熔融氯化鎂,可以得到金屬鎂 D.硫酸工業:在氧氣充足的情況下,從接觸室進入吸收塔的氣體中不可能含有SO2 組卷:27引用:2難度:0.7 -
2.化學與社會、科學、技術、環境密切相關,下列說法錯誤的是( )
A.鐵表面鍍鋅可以增強鐵的抗腐蝕性 B.采用合適的催化劑可以提高合成氨工業中原料的轉化率 C.合理利用太陽能、風能和氫能等能源有利于實現“低碳經濟” D.燃料的脫硫脫氮、SO2的回收利用和NOx的催化轉化都是減少酸雨產生的措施 組卷:10引用:1難度:0.7 -
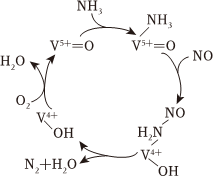 3.有氧條件下,NO在催化劑作用下可被NH3還原為N2,脫硝反應機理如圖所示,下列有關說法錯誤的是( )
3.有氧條件下,NO在催化劑作用下可被NH3還原為N2,脫硝反應機理如圖所示,下列有關說法錯誤的是( )A.脫硝過程中V5+=O是中間產物 B.脫硝過程中化合價變化的元素有三種 C.脫硝過程中涉及非極性鍵的斷裂和形成 D.總反應方程式為4NH3+4NO+O2 4N2+6H2O催化劑組卷:10引用:3難度:0.7 -
4.下列有關熱化學方程式的敘述正確的是( )
A.2H2(g)+O2(g)═2H2O(g)ΔH=-483.6kJ?mol-1,則氫氣的燃燒熱為241.8kJ?mol-1 B.S(g)+O2(g)═SO2(g)ΔH1;S(s)+O2(g)═SO2(g)ΔH2,則ΔH1>ΔH2 C.N2(g)+3H2(g)?NH3(g)△ΔH=-92kJ?mol-1,1mol N2和3mol H2充分反應,放出92kJ熱量 D.在稀溶液中,H+(aq)+OH-(aq)═H2O(l)ΔH=57.3kJ?mol-1,若將1mol NaOH固體加入1L1mol?L-1的稀鹽酸溶液中,放出的熱量大于57.3kJ 組卷:142引用:3難度:0.7 -
5.侯德榜是我國著名愛國科學家,他放棄國外的優厚待遇,毅然回國報效祖國,為我國的化學工業辛勤奮斗了一生。他發明的侯氏制堿法在國際上獲獎,振奮了中國人民的志氣。侯氏制堿法的工業流程如圖:
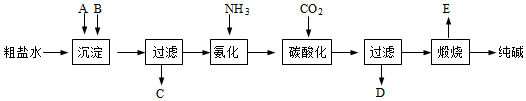
實驗室模擬工業上侯氏制堿原理制備純堿,下列操作未涉及的是( )A. 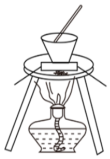
B. 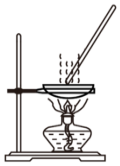
C. 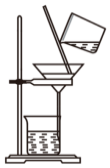
D. 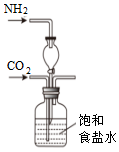 組卷:31引用:2難度:0.7
組卷:31引用:2難度:0.7 -
6.一定條件下,在容積固定的某密閉容器中發生的反應N2+3H2?2NH3.在10s內N2的濃度由5mol/L降至4mol/L下列說法正確的是( )
A.用NH3表示的化學反應速率為0.1mol/(L?s) B.使用合適的催化劑,可以加快該反應的速率 C.增加H2的濃度或降低溫度都會加快該反應的速率 D.反應足夠長時間,N2、H2中至少有一種物質濃度降為零 組卷:146引用:16難度:0.9
二、填空題
-
17.鉻酸鹽是指含鉻酸根(CrO42-)的鹽類。鉻酸鹽最顯著的特點是具有鮮明的顏色,如BaCrO4呈黃色,Ag2CrO4呈磚紅色。
I、工業廢水中常含有一定量的CrO72-和CrO42-,它們會對人類及生態系統產生很大的傷害,必須進行處理。還原沉淀法是常用的處理方法之一,工藝流程如下:CrO42-Cr2O72-H+①轉化Cr3+Fe2+②還原Cr(OH)3。OH-③沉淀
(1)第①步中,轉化反應的離子方程式為:,該體系pH=2時,溶液呈色。
(2)第③步中,要使Cr3+沉淀完全,應調整溶液的pH≥。(已知常溫下,Ksp[Cr(OH)3]=1.0×10-32)
II、莫爾法是用K2CrO4作指示劑,用AgNO3作標準溶液的測定Cl-(或Br-)的方法。現用莫爾法測定亞硝酰氯樣品中NOCl的純度,實驗步驟如下:
步驟1:取mgNOCl樣品,溶于蒸餾水(發生反應:NOCl+H2O═HNO2+HCl),配制成250mL溶液,準確量取25.00mL溶液于錐形瓶中:
步驟2:加入適量K2CrO4溶液作指示劑,用cmol?L-1AgNO3標準溶液滴定至終點,消耗標準溶液的體積為VmL;
(3)滴定終點的標志是。
(4)亞硝酰氯樣品中NOCl的純度為。
(5)若滴定終點時俯視讀數,所測NOCl的純度(填“偏高”、“偏低”、“不變”)。組卷:6引用:3難度:0.6 -
18.錳酸鋰離子蓄電池是第二代鋰離子動力電池。一種以軟錳礦漿(主要成分為MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等雜質)為原料制備錳酸鋰的流程如圖所示。
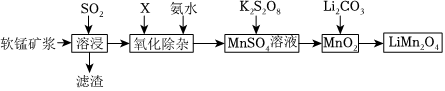
(1)溶浸生產中為提高SO2吸收率可采取的措施有。(填序號)
a.不斷攪拌,使SO2和軟錳礦漿充分接觸
b.減小通入SO2的流速
c.減少軟錳礦漿的進入量
d.增大通入SO2的流速
(2)已知:室溫下,Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1時Mn(OH)2開始沉淀。氧化除雜時(室溫)除去MnSO4溶液中的Fe3+、Al3+(使其濃度小于1×10-6mol/L),需調節溶液pH范圍為。
(3)由硫酸錳與K2S2O8(結構為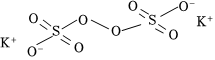 )溶液常溫下混合一周,慢慢得到球形二氧化錳(MnO2)。請寫出該反應的化學方程式為 。
)溶液常溫下混合一周,慢慢得到球形二氧化錳(MnO2)。請寫出該反應的化學方程式為 。
(4)將MnO2和Li2CO3按4:1的物質的量比配料,混合攪拌,然后升溫至600~750℃,制取產品LiMn2O4并生成兩種氣體。寫出該反應的化學方程式為。
(5)錳酸鋰可充電電池的總反應為Li1-xMn2O4+LixCLiMn2O4+C(0<x<1)放電充電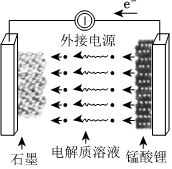
①放電時電池內部Li+向移動。(填“正極”或“負極”)
②充電時,電池的陽極反應式為,若此時轉移1mol e-,則石墨電極將增重g。組卷:35引用:4難度:0.5


