2021-2022學年重慶市朝陽中學高二(上)月考化學試卷(10月份)
發布:2024/11/5 0:0:2
一、選擇題:本題共14小題,每小題3分,共42分。每小道只有一個選項符合題目要求。
-
1.下列說法正確的是( )
A.氫氧燃料電池放電時化學能全部轉化為電能 B.反應4Fe(s)+3O2(g)═2Fe2O3(s)常溫下可自發進行,該反應為吸熱反應 C.一定條件下,向密閉容器中充入3molH2與1molN2,使其充分混合反應生成NH3,轉移電子的數目小于6×6.02×1023 D.在酶催化淀粉水解反應中,溫度越高淀粉水解速率越快 組卷:6引用:1難度:0.7 -
2.少量鐵粉與100mL0.01mol?L-1的稀鹽酸反應,反應速率太慢。為了加快此反應速率而不改變H2的產量,可以使用如下方法中的( )
①加H2O
②加NaOH固體
③滴入幾滴濃鹽酸
④加CuO固體
⑤加NaCl溶液
⑥滴加幾滴硫酸銅溶液
⑦升高溫度(不考慮鹽酸揮發)
⑧改用10mL0.1mol?L-1的鹽酸A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧ 組卷:34引用:3難度:0.7 -
3.下列說法正確的是( )
A.升高溫度能使化學反應速率增大,主要原因是增加了反應物分子中活化分子的百分數 B.有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加活化分子的百分數,從而使反應速率增大 C.增大反應物濃度,可增大單位體積內活化分子的百分數,從而使有效碰撞次數增大 D.催化劑不影響反應活化能但能增大單位體積內活化分子百分數,從而增大反應速率 組卷:48引用:26難度:0.7 -
4.某溫度下,體積一定的密閉容器中發生如下可逆反應:2X(g)+Y(s)?3Z(g)△H=QkJ/mol,下列說法正確的是( )
A.消耗2 molX同時生成3 molZ,說明達到了平衡狀態 B.加入少量的Y正反應速率加快 C.氣體的密度不變時,說明達到了平衡狀態 D.加入少量的X,Q變大 組卷:68引用:5難度:0.7 -
5.反應:3A(g)+B(g)=2C(g)+2D(g),在不同條件下,用不同物質表示其反應速率,分別為
①v(A)=0.6mol?L-1?min-1
②v(B)=0.45mol?L-1?min-1
③v(C)=0.15mol?L-1?min-1
④v(D)=0.45mol?L-1?min-1
則此反應在不同條件下進行快慢順序正確的是( )A.①>②>③>④ B.①>②=④>③ C.②>④>③>① D.②>④>①>③ 組卷:39引用:2難度:0.8 -
6.下列裝置或操作能達到目的的是( )
 ①
①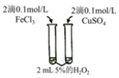
②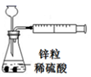
③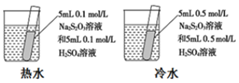
④A.裝置①依據溶液顏色變化研究酸堿性對平衡移動的影響 B.裝置②用于比較Cu2+和Fe3+對H2O2分解速率的影響 C.裝置③用于測定生成的氫氣的速率 D.裝置④依據出現渾濁的快慢比較溫度對反應速率的影響 組卷:4引用:1難度:0.5
二、非選擇題:本題共5小題,共58分
-
18.已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ?mol-1 K1=a
C(s)+O2(g)=CO2(g)△H2=-393.5 kJ?mol-1 K2=b
2C(s)+O2(g)=2CO(g)△H3=-221.0 kJ?mol-1 K3=c
若某反應的平衡常數表達式為K=,請根據以上反應寫出此反應的熱化學方程式c(N2)?c2(CO2)c2(NO)?c2(CO)。該反應的K=(用a、b、c表示)。組卷:1引用:1難度:0.7 -
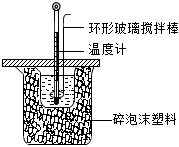 19.利用如圖裝置測定中和熱的實驗步驟如下:
19.利用如圖裝置測定中和熱的實驗步驟如下:
①用量筒量取50mL0.25mol?L-1硫酸倒入小燒杯中,測出硫酸溫度;
②用另一量筒量取50mL0.55mol?L-1NaOH溶液,并用另一溫度計測出其溫度;
③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測出混合液的最高溫度。
回答下列問題:
(1)倒入NaOH溶液的正確操作是(填字母序號,下同)。
A.沿玻璃棒緩慢倒入
B.分三次少量倒入
C.一次迅速倒入
(2)燒杯間填滿碎泡沫塑料的作用是。
(3)使硫酸與NaOH溶液混合均勻的正確操作是。
a.用溫度計小心攪拌
b.揭開硬紙片用玻璃棒攪拌
c.輕輕地振蕩燒杯
d.用套在溫度計上的環形玻璃攪拌棒輕輕地攪動
(4)實驗數據如表:
①反應后溶液的比熱容c=4.18J/(g?℃),硫酸溶液和氫氧化鈉溶液密度近似為1g?cm-3,依據該學生的實驗數據計算,溫度差平均值為溫度
實驗次數起始溫度t℃ 終止溫度
t2/℃溫度差
平均值
(t2-t1)/℃H2SO4 NaOH 平均值 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 ℃,該實驗測得的中和熱ΔH=kJ/mol(保留一位小數)。
②該實驗測得的中和熱ΔH與理論值有偏差,其原因可能是。
a.用量筒量取硫酸溶液仰視讀數
b.大燒杯上硬紙板沒蓋好
c.大、小燒杯體積相差較大,夾層間放的碎泡沫塑料較多
d.測量完硫酸溶液溫度的溫度計直接用來測NaOH溶液的溫度
(5)現將一定量的稀氫氧化鈉溶液、稀氫氧化鋇溶液分別和1L0.5mol?L-1的稀硫酸恰好完全反應,其反應熱分別為ΔH1、ΔH2,則ΔH1ΔH2(填“>、<或=”)。組卷:7引用:1難度:0.6


