2021-2022學年遼寧省朝陽市建平實驗中學高二(下)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括20小題,每題3分共60分,每小題只有一個選項符合題意。)
-
1.下列有關物質結構的表述正確的是( )
A.次氯酸的電子式: 
B.二氧化硅的分子式:SiO2 C.硫原子的最外層電子排布式:2s22p4 D.鈉離子的結構示意圖:  組卷:4引用:1難度:0.7
組卷:4引用:1難度:0.7 -
2.晶體與非晶體的本質差別是( )
A.有無各向異性 B.有無一定的幾何外形 C.有無固定熔點 D.構成固體的粒子在三維空間里是否呈現周期性的有序排列 組卷:32引用:1難度:0.5 -
3.a、b、c、d是四種短周期元素。a、b、d同周期,c、d同主族。a的原子結構示意圖為
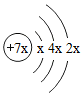 ,b與c形成的化合物的電子式為
,b與c形成的化合物的電子式為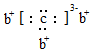 。下列說法中正確的是( )
。下列說法中正確的是( )A.原子半徑:a>c>d>b B.電負性:a>b>d>c C.原子序數:d>a>c>b D.最高價含氧酸的酸性:c>d>a 組卷:136引用:13難度:0.7 -
4.科學家在海底發現一種新能源--“可燃冰”,它的主要成分是甲烷與水分子的結晶水合物(CH4?nH2O)。其形成過程為:埋于海底地層深處的大量有機質在缺氧環境中,厭氧性細菌分解,最后形成石油和天然氣(石油氣),其中許多天然氣被包進水中,在海底的低溫與高壓環境下形成了類似冰的透明晶體,這就是“可燃冰”。又知甲烷同CO2一樣也是溫室氣體。這種可燃冰的晶體類型是( )
A.離子晶體 B.分子晶體 C.原子晶體 D.金屬晶體 組卷:91引用:15難度:0.9 -
5.配位化合物的數量巨大,組成和結構形形色色,豐富多彩.請指出配合物[Cu(NH3)4](OH)2 的中心離子、配體、中心離子的電荷數和配位數( )
A.Cu2+、NH3、+2、4 B.Cu+、NH3、+1、4 C.Cu2+、OH-、+2、2 D.Cu2+、NH3、+2、2 組卷:202引用:14難度:0.9 -
6.下列數據是對應物質的熔點,有關的判斷錯誤的是( )
Na2O Na AlF3 AlCl3 Al2O3 BCl3 CO2 SiO2 920℃ 97.8℃ 1291℃ 190℃ 2073℃ -107℃ -57℃ 1723℃ A.含有金屬陽離子的晶體一定是離子晶體 B.在共價化合物分子中各原子不一定都形成8電子結構 C.同族元素的氧化物可形成不同類型的晶體 D.金屬晶體的熔點不一定比分子晶體的高 組卷:33引用:1難度:0.6 -
7.下列物質的性質與氫鍵無關的是( )
A.冰的密度比水的密度小 B.氨氣極易溶于水 C.SbH3 的沸點比PH3高 D.沸點:鄰羥基苯甲醛<對羥基苯甲醛 組卷:77引用:2難度:0.5 -
8.據報道,大氣中存在一種潛在的溫室氣體SF5-CF3,下列關于SF5-CF3的說法正確的是( )
A.分子中既有σ鍵也有π鍵 B.所有原子在同一平面內 C.分子中并非所有原子均滿足8電子穩定結構 D.0.1 mol SF5-CF3分子中含8 mol電子 組卷:33引用:3難度:0.6
二、非選擇題共40分
-
 23.元素X位于第四周期,其基態原子的內層軌道全部排滿電子,且最外層電子數為2。元素Y基態原子的3p軌道上有4個電子。元素Z的原子最外層電子數是其內層的3倍。
23.元素X位于第四周期,其基態原子的內層軌道全部排滿電子,且最外層電子數為2。元素Y基態原子的3p軌道上有4個電子。元素Z的原子最外層電子數是其內層的3倍。
(1)在第三周期中,第一電離能大于Y的主族元素有。
(2)X與Y所形成化合物晶體的晶胞如圖所示。該化合物的化學式為。
(3)Z的氫化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是。
(4)Y與Z形成YZ42-的空間結構為。
(5)X的氯化物與氨水反應可形成配合物[X(NH3)4]Cl2,1mol該配合物中含有σ鍵的數目為(阿伏加德羅常數用NA表示)組卷:8引用:1難度:0.5 -
 24.鍺(Ge)是典型的半導體元素,在電子、材料等領域應用廣泛。回答下列問題:
24.鍺(Ge)是典型的半導體元素,在電子、材料等領域應用廣泛。回答下列問題:
(1)基態Ge原子的核外電子排布式為,有個未成對電子。
(2)Ge與C是同族元素,C原子之間可以形成雙鍵、三鍵,但Ge原子之間難以形成雙鍵或三鍵。從原子結構角度分析,原因是。
(3)比較下列鍺鹵化物的熔點和沸點,分析其變化規律及原因。
(4)光催化還原CO2制備CH4反應中,帶狀納米Zn2GeO4是該反應的良好催化劑。Zn、Ge、O電負性由大至小的順序是GeCl4 GeBr4 GeI4 熔點/℃ -49.5 26 146 沸點/℃ 83.1 186 約400 。
(5)Ge單晶具有金剛石型結構,其中Ge原子的雜化方式為,微粒之間存在的作用力是。
(6)晶胞有兩個基本要素:
①原子坐標參數,表示晶胞內部各原子的相對位置,如圖為Ge單晶的晶胞,其中原子坐標參數A為(0,0,0);B為(,0,12);C為(12,12,0)。則D原子的坐標參數為12。
②晶胞參數,描述晶胞的大小和形狀。已知Ge單晶的晶胞參數a=565.76pm,其密度為g?cm-3(列出計算式即可)。組卷:314引用:10難度:0.5


