2023年河南省安陽一中高考化學模擬試卷(四)
發布:2024/12/24 7:0:2
一、選擇題(本題包括40小題,1-30題每小題1分,31-40題每小題1分,每小題只有一個選項符合題意。請將正確答案填涂在答題卡的相應位置。)
-
1.下列對古文獻記載內容或詩句諺語理解不正確的是( )
A.《本草綱目》“燒酒”條目下寫道:“自元時始創其法,用濃酒和糟入甑,蒸令氣……其清如水,味極濃烈,蓋酒露也”。這里所用的“法”是指蒸餾 B.“水滴石穿、繩鋸木斷”不包含化學變化 C.《夢溪筆談》記載:“熬膽礬鐵釜,久之亦化為銅”中涉及到的反應有置換反應 D.“忽聞海上有仙山,山在虛無縹緲間”中的海市蜃樓是一種自然現象,與膠體知識有關 組卷:37引用:4難度:0.8 -
2.化學與社會都密切相關,下列說法正確的是( )
A.軍艦船底鑲嵌鋅塊作正極,以防船體被腐蝕 B.汽車尾氣中NO和CO可以緩慢反應生成N2和CO2,減小壓強反應速率減慢 C.金屬冶煉過程是金屬離子得電子變成金屬單質的氧化過程 D.PM2.5顆粒(微粒直徑約為2.5×10-6m)分散在空氣中形成氣溶膠 組卷:100引用:5難度:0.9 -
3.下列化學用語正確的有( )
①乙酸的最簡式:CH2O
②聚丙烯的結構簡式:
③羥基的電子式:
④丙烷分子的比例模型:
⑤四氯化碳分子的電子式:
⑥H2CO3的電離方程式:H2CO3?H++HCO-3A.1個 B.2個 C.3個 D.4個 組卷:74引用:2難度:0.7 -
4.化學與生活、生產密切相關。下列物質的應用和性質及對應關系均正確的是( )
選項 應用 性質 A 葡萄糖在人體內為人類生命活動提供能量 發生氧化反應放出熱量 B “84”消毒液與潔廁靈混合使用 反應生成消毒和去污效果更好的物質 C 75%酒精、雙氧水均可滅活新冠病毒 均使蛋白質被氧化而變性 D 熱的純堿溶液常用于洗滌金屬表面的柴油 能使柴油水解生成溶于水的物質 A.A B.B C.C D.D 組卷:19引用:3難度:0.7 -
5.設NA為阿伏加德羅常數的值。下列說法不正確的是( )
A.把盛有1molNO2的密閉容器降溫,容器中的分子數少于NA B.100℃時,1LpH=6的純水中,含有的OH-數目為1×10-8NA C.1mol的CO2和H2O(g)的混合氣體與過量Na2O2充分反應轉移的電子數為NA D.0.2molC2H6與1.0molCl2在光照下充分反應,產物中C-Cl鍵總數為1.0NA 組卷:12引用:2難度:0.7 -
6.向下列溶液中通入足量相應氣體后,各離子組還能大量存在的是( )
A.二氧化碳:K+、Na+、 、Cl-CO2-3B.氨氣:Mg2+、Al3+、Na+、 NO-3C.氯化氫:Ca2+、Fe3+、 、Cl-NO-3D.氯氣:Na+、Ba2+、 、HCO-3HSO-3組卷:168引用:13難度:0.8 -
7.下列實驗現象及相關的離子方程式均正確的是( )
A.碳酸鈣粉末中加入醋酸溶液,固體逐漸減少,生成無色氣體:CaCO3+2H+=Ca2++CO2+H2O B.向BaCl2溶液中通入SO2氣體,出現白色沉淀:Ba2++SO2+H2O=BaSO3+2H+ C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2 +7H2O2+6H+=2Mn2++6O2+10H2OMnO-4D.將等物質的量濃度、等體積的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀:Ba2++ +H++OH-=BaSO4↓+H2OSO2-4組卷:58引用:1難度:0.7 -
8.如圖所示,縱軸表示導電能力,橫軸表示所加溶液的量,下列說法正確的是( )

A.曲線A表示NaOH溶液中滴加稀鹽酸 B.曲線B表示CH3COOH溶液中滴加KOH溶液 C.曲線C表示Ba(OH)2溶液中滴加稀硫酸 D.曲線D表示Cu(OH)2懸濁液中滴加HNO3溶液 組卷:633引用:22難度:0.7 -
9.下列實驗中,所采取的分離方法與對應原理都正確的是( )
選項 目的 分離方法 原理 A 分離溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度較大 B 分離乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同 C 除去KNO3固體中混雜的NaCl 重結晶 NaCl在水中的溶解度很大 D 除去丁醇中的乙醚 蒸餾 丁醇與乙醚的沸點相差較大 A.A B.B C.C D.D 組卷:3998引用:93難度:0.9 -
10.下列各組澄清溶液中離子能大量共存,且加入(或滴入)X試劑后發生反應的離子方程式書寫正確的是( )
A.離子組:K+、H+、 ;X試劑:少量Ba(OH)2;離子方程式:Ba2++OH-+H++SO2-4=BaSO4↓+H2OSO2-4B.離子組:Fe2+、Cl-、H+;X試劑:少量NaNO3;離子方程式:3Fe2++ +4H+=NO↑+2H2O+3Fe3+NO-3C.離子組:Na+、Fe3+、 ;X試劑:過量KSCN;離子方程式:Fe3++3SCN-=Fe(SCN)3↓NO-3D.離子組: 、H+、NH+4;X試劑:過量NaOH;離子方程式:HCO-3+H++NH+4+3OH-=NH3?H2O+2H2O+HCO-3CO2-3組卷:38引用:2難度:0.7 -
11.常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.水電離的C =1×10-13mol/L的溶液:K+、Na+、AlO2-、CO32-(H+)B. =1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-Kwc(H+)C.與Al反應能放出H2的溶液:Cu2+、NO3-、K+、SO42- D.無色溶液中:Cr2O72-、Na+、H+、SO42- 組卷:37引用:4難度:0.8 -
12.下列實驗能達到目的的是( )




A.實驗室制取氨氣 B.為確認CuSO4生成,向①中加水,觀察顏色 C.制備純凈的
Fe(OH)2D.除去Cl2中含有的少量HCl氣體 A.A B.B C.C D.D 組卷:58引用:3難度:0.5 -
13.下列四組混合氣體中各組分的體積比為①NO2:O2=2:1;②NO:O2=2:1;③NH3:O2=2:1;④NO2:NO:O2=1:1:1。將分別盛滿上述各種氣體的容積相等的四支試管倒置于盛有水的水槽中,最后試管內液面由低到高的順序為( )
A.③②①④ B.①③④② C.②③①④ D.①④②③ 組卷:37引用:1難度:0.6 -
14.重鉻酸鉀(K2Cr2O7)是一種重要的化工原料。以鉻鐵礦(主要成分為FeO?Cr2O3,還含有Al2O3,Fe2O3等雜質)為原料制備重鉻酸鉀的一種工藝流程如圖,下列敘述錯誤的是( )

A.“焙燒”過程中,FeO?Cr2O3轉化為Na2CrO4和Fe2O3 B.“濾渣”的主要成分是Al(OH)3 C.“酸化”的目的是使 轉化為Cr2CrO2-4O2-7D.由流程圖可知,溶解度:Na2Cr2O7<K2Cr2O7 組卷:30引用:2難度:0.6
二、解答題(共4小題,滿分0分)
-
 43.乙烯是合成食品外包裝材料聚乙烯的單體,可以由丁烷裂解制備。
43.乙烯是合成食品外包裝材料聚乙烯的單體,可以由丁烷裂解制備。
主反應:C4H10(g,正丁烷)?C2H4(g)+C2H6(g)ΔH1
副反應:C4H10(g,正丁烷)?CH4(g)+C3H6(g)ΔH2
回答下列問題:
(1)化學上,將穩定單質的能量定為0,生成穩定化合物時的釋放或吸收能量叫生成熱,生成熱可表示該物質相對能量。如表為25℃、101kPa下幾種有機物的生成熱:
①表格中的物質,最穩定的是物質 甲烷 乙烷 乙烯 丙烯 正丁烷 異丁烷 生成熱/kJ?mol-1 -75 -85 52 20 -125 -132 (填結構簡式)。
②上述反應中,ΔH1=kJ/mol。
(2)一定溫度下,在恒容密閉容器中投入一定量正丁烷發生反應生成乙烯。
①下列情況表明該反應達到平衡狀態的是(填代號)。
A.氣體密度保持不變
B.氣體壓強保持不變
C.反應熱不變
D.正丁烷分解速率和乙烷消耗速率相等
②為了同時提高反應速率和轉化率,下列措施可采用的是(填代號)。
A.加入高效催化劑
B.升高溫度
C.充入乙烷
D.減小壓強
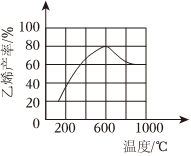
(3)向密閉容器中充入丁烷,在一定條件(濃度、催化劑及壓強等)下發生反應,測得乙烯產率與溫度關系如圖所示。溫度高于600℃時,隨著溫度升高,乙烯產率降低,可能的原因是(填代號)。
A.平衡常數降低
B.活化能降低
C.催化劑活性降低
D.副產物增多
(4)在一定溫度下向1L恒容密閉容器中充入2mol正丁烷,反應生成乙烯和乙烷,經過10min達到平衡狀態,測得平衡時氣體壓強是原來的1.75倍。
①0~10min內乙烯的生成速率v(C2H4)為mol?L-1?min-1。
②上述條件下,該反應的平衡常數K為。
(5)丁烷-空氣燃料電池以熔融的K2CO3為電解質,以具有催化作用和導電性能的稀土金屬材料為電極。該燃料電池的負極反應式為。組卷:34引用:2難度:0.5 -
44.液晶高分子材料應用廣泛.新型液晶基元-化合物Ⅳ的合成線路如下:

(1)化合物Ⅰ的分子式為,1mol化合物Ⅰ完全燃燒消耗mol O2.
(2)CH2=CH-CH2Br與NaOH水溶液反應的化學方程式為(注明條件).
(3)寫出符合下列條件的化合物Ⅰ的同分異構體的結構簡式.
Ⅰ.苯環上有3個取代基Ⅱ.苯環上一溴代物只有2種Ⅲ.能發生銀鏡反應
(4)下列關于化合物Ⅱ的說法正確的是(填字母).
A.屬于烯烴
B.能與FeCl3溶液反應呈紫色
C.一定條件下能發生加聚反應
D.最多能與4mol H2發生加成反應
(5)反應③的反應類型是.在一定條件下,化合物 也可與Ⅲ發生類似反應③的反應生成有機物Ⅴ.Ⅴ的結構簡式是 .組卷:26引用:5難度:0.3
也可與Ⅲ發生類似反應③的反應生成有機物Ⅴ.Ⅴ的結構簡式是 .組卷:26引用:5難度:0.3


