2020-2021學年浙江省嘉興市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意,每小題2分,共50分)
-
1.下列物質的水溶液呈堿性的是( )
A.NH4Cl B.Na2CO3 C.NaCl D.NaHSO4 組卷:13引用:1難度:0.7 -
2.下列物質屬于電解質的是( )
A.CO2 B.H2SO4溶液 C.Na2SO4固體 D.C2H5OH(乙醇) 組卷:24引用:1難度:0.8 -
3.下列化學用語的表述錯誤的是( )
A.明礬的化學式:KAl(SO4)2?12H2O B.NH3分子的球棍模型: 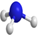
C.鋁原子的結構示意圖: 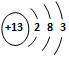
D.N2的電子式: 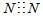 組卷:9引用:1難度:0.8
組卷:9引用:1難度:0.8 -
4.下列電離方程式錯誤的是( )
A.H2CO3?2H++CO32- B.2H2O?H3O++OH- C.NaHCO3=Na++HCO3- D.CH3COOH?CH3COO-+H+ 組卷:105引用:3難度:0.8 -
5.利用如圖裝置進行實驗,能達到實驗目的的是( )
A. 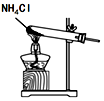
裝置:制取氨氣B. 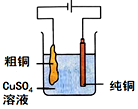
裝置:精煉銅C. 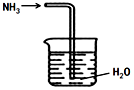
裝置:吸收NH3D. 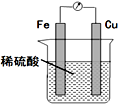
裝置:比較金屬鐵、銅的活潑性組卷:3引用:1難度:0.5 -
6.化學與科學技術的發展密切相關,技術的進步為化學的研究奠定了基礎。下列說法錯誤的是( )
A.利用pH計能判斷酸堿中和滴定的終點 B.硅太陽能電池工作時把化學能轉化為電能 C.利用飛秒激光脈沖技術使化學動力學研究進入分子動態學的領域 D.利用比色分析的分光光度計可以幫助測定某些化學反應的反應速率 組卷:14引用:1難度:0.6 -
7.下列關于金屬腐蝕的說法錯誤的是( )
A.河水中的鋼閘門連接電源的負極,使用的是外加電流的陰極保護法 B.金屬腐蝕的實質就是金屬原子失去電子被氧化的過程 C.鍍鋅鐵皮(白鐵皮)的鍍層破損后鐵皮仍耐腐蝕 D.鋼鐵在潮濕的空氣中生銹,主要發生了析氫腐蝕 組卷:36引用:2難度:0.8 -
8.下列說法與鹽類的水解無關的是( )
A.為保存FeSO4溶液,需在溶液中加少量鐵粉 B.配制FeCl3溶液時,先將氯化鐵固體溶于鹽酸,再加水稀釋 C.將AlCl3溶液蒸干灼燒,所得固體為Al2O3 D.銨態氮肥不能與草木灰(主要成分是K2CO3)混合施用 組卷:46引用:1難度:0.7 -
9.甲烷消除NO2的污染原理為:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)。在一定溫度下,向恒容密閉容器中充入一定量的CH4和NO2進行上述反應。下列表述能用來判斷該反應達到化學平衡狀態的是( )
A.v正(CH4)=2v逆(NO2) B.容器中混合氣體的平均密度不再變化 C.容器中混合氣體總壓強不再發生變化 D.單位時間內,消耗1mol CH4同時生成1mol CO2 組卷:121引用:3難度:0.6 -
10.下列說法錯誤的是( )
A.生物質能來源于植物及其加工產品所貯存的能量 B.利用化石燃料燃燒放出的熱量使水分解產生氫氣,是氫能開發的研究方向 C.化學電源放電、植物光合作用都發生了化學變化,并伴隨能量的轉化 D.開發利用各種新能源,減少對化石燃料的依賴,可以減少空氣中PM2.5的排放 組卷:90引用:2難度:0.4
二、分析填空題(共6個小題,共50分)
-
30.某興趣小組用廢鋁合金(成分為Al、Zn、Fe、Si)制備Al2O3和Fe2O3、ZnSO4?7H2O,流程如圖。
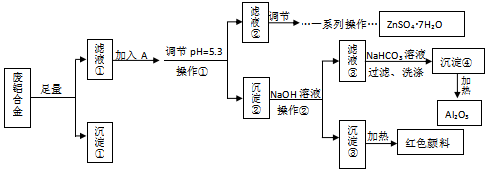
已知:①ZnSO4?7H2O晶體易溶于水,易風化。
②已知25℃常見離子沉淀的pH范圍如表。
回答下列問題:開始沉淀 完全沉淀 Fe3+ 1.5 3.7 Fe2+ 6.5 9.7 Al3+ 3.3 5.2 Zn2+ 5.4 8.2
(1)下列操作或描述正確的是。
A.加入試劑A目的是將Fe2+氧化為Fe3+
B.調節pH=5.3,可用試劑ZnO
C.操作②中用玻璃棒在過濾器上攪拌以加快過濾速度
D.為制備ZnSO4?7H2O,可蒸發ZnSO4溶液至有大量晶體析出,再停止加熱,用余熱蒸干
(2)調節pH=2的目的是。
(3)寫出濾液③中加入碳酸氫鈉溶液生成沉淀④的反應的離子方程式。
(4)為了得到純凈的沉淀③,需要將沉淀③進行洗滌。洗滌沉淀的具體操作是。
(5)判斷濾液②是否有鐵元素殘留的簡要實驗方案為。組卷:3引用:1難度:0.6 -
31.苯乙烯是一種重要的化工原料,可采用乙苯催化脫氫法制備,反應如下:
 CH2-CH3(g)?
CH2-CH3(g)? CH=CH2(g)+H2(g)△H=+17.6kJ?mol-1
CH=CH2(g)+H2(g)△H=+17.6kJ?mol-1
(1)該反應在條件下能自發進行;既能提高該反應的速率又能提高乙苯的平衡轉化率的單一措施是。
(2)工業上,通常在乙苯蒸氣中摻混水蒸氣,并讓反應在恒壓下進行。從平衡移動的角度說明這樣操作的理由是。
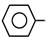
(3)當原料氣中乙苯和水蒸氣的物質的量之比為1:4,反應在恒容容器中進行,測得容器總壓P(總)和乙苯轉化率α隨時間變化結果如圖1所示。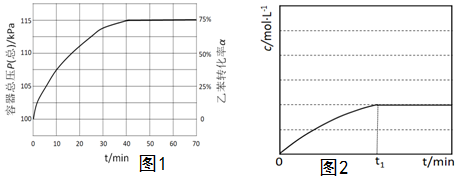
已知:A物質的分壓為P(A)=×P(總)。n(A)n(總)
回答下列問題:
①平衡時水的分壓P(H2O)=kPa。
②已知:ν正=k正P(乙苯),ν逆=k逆P(苯乙烯)×P(氫氣),k正、k逆分別為正、逆反應速率常數。則:=k正k逆kPa。
(4)在相同的溫度和催化劑的情況下,amol乙苯在VL的恒容容器中發生反應。苯乙烯的濃度隨時間的變化示意圖見圖2。若其它條件不變,amol乙苯在L的容器中發生該反應,在圖2中重新畫出苯乙烯的濃度隨時間的變化示意圖V2。組卷:14引用:1難度:0.5


