2021-2022學年廣東省廣州市部分學校高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(16題共44分,1-10題每題2分,11-16題每題4分)
-
1.下列各組關于強電解質、弱電解質,非電解質的歸類,完全正確的是( )
選項 A B C D 強電解質 Fe NaCl CaCO3 HNO3 弱電解質 CH3COOH NH3 H3PO4 Fe(OH)3 非電解質 蔗糖 BaSO4 酒精 Cl2 A.A B.B C.C D.D 組卷:133引用:11難度:0.8 -
2.下列說法或表示方法正確的是( )
A.C(s)的燃燒熱是393.5kJ?mol-1,則2C(s)+O2(s)=2CO(g)的ΔH=-787kJ?mol-1 B.由C(石墨,s)=C(金剛石,s)ΔH=+1.9kJ?mol-1可知金剛石比石墨穩定 C.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下ΔH不相同 D.在稀溶液中:H+(aq)+OH-(aq)=H2O(1)ΔH=-57.3kJ?mol-1,若將含2mol CH3COOH與含2mol NaOH的稀溶液混合,放出的熱量小于114.6kJ 組卷:30引用:6難度:0.5 -
3.某同學設計如圖所示實驗,探究反應中的能量變化。下列判斷正確的是( )

A.實驗①、②、③所涉及的反應都是放熱反應 B.實驗②反應物的總能量高于生成物的總能量 C.若用NaOH固體測定中和熱,則測定結果偏高 D.實驗③中將環形玻璃攪拌棒改為鐵質攪拌棒對實驗結果沒有影響 組卷:82引用:11難度:0.8 -
4.可逆反應A(g)+3B(g)?2C(g)△H=-92.4kJ?mol-1,下列說法錯誤的是( )
A.正反應的活化能一定小于92.4kJ?mol-1 B.逆反應的活化能一定大于92.4kJ?mol-1 C.逆反應的活化能比正反應的活化能高92.4kJ?mol-1 D.使用催化劑,正、逆反應的活化能都減小 組卷:26引用:5難度:0.7 -
5.下列說法錯誤的是( )
A.放熱過程(△H<0)或熵增加(△S>0)的過程一定是自發的 B.1mol H2O在不同狀態時的值:S[H2O(s)]<S[H2O(g)] C.食物在常溫下變質是自發進行的 D.自發反應2H2(g)+O2(g)═2H2O(l)△H<0可用能量判據來解析 組卷:12引用:3難度:0.5 -
6.下列有關化學反應速率的實驗探究方案設計合理的是( )
選項 實驗方案 實驗目的 A 向等體積等濃度的H2O2溶液中分別加入5滴等濃度的CuSO4和FeCl3溶液,觀察氣體產生的速度 比較Cu2+和Fe3+的催化效果 B 兩支試管,都加入2mL 1mol/L的酸性KMnO4溶液,再同時向兩支試管分別加入2mL 0.1mol/L的H2C2O4溶液和2mL 0.05mol/L的H2C2O4溶液,觀察高錳酸鉀溶液褪色所需時間 探究草酸濃度對反應速率影響 C 在錐形瓶內各盛有2g鋅粒(顆粒大小基本相同),然后通過分液漏斗分別加入40mL 1mol/L和40mL 18mol/L的硫酸。比較兩者收集10mL氫氣所用的時間 
探究硫酸濃度對反應速率影響 D 
探究溫度對反應速率的影響 A.A B.B C.C D.D 組卷:83引用:16難度:0.5
二、非選擇題(4小題,共56分,每小題14分,每空2分)
-
19.在25℃時,有關物質的電離平衡常數如下:
(1)請寫出H2SO3的電離平衡常數K1的表達式:化學式 CH3COOH H2CO3 H2SO3 電離平衡常數 K=1.8×10-5 K1=4.4×10-7
K2=4.7×10-11K1=1.5×10-2
K2=1.02×10-7。
(2)常溫下,將體積為10mL pH=2的醋酸溶液與體積為10mL pH=2亞硫酸溶液分別加蒸餾水稀釋至1000mL,稀釋后溶液的pH,前者后者(填“>”、“<”或“=”)。
(3)一定條件下,冰醋酸加水稀釋過程中溶液導電能力I隨加水體積V變化曲線如右圖所示,則a、b、c三點溶液醋酸的電離程度由小到大為。
(4)下列離子CH3COO-、CO32-、HSO3-、SO32-在溶液中結合H+的能力由大到小的關系為。
(5)體積相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4三種酸溶液分別與同濃度的NaOH溶液完全中和時,消耗NaOH溶液的體積由大到小的排列順序是(填序號)。
(6)常溫下0.1mol?L-1的CH3COOH溶液在加水稀釋過程中,下列表達式數據增大的是(填字母序號)。
A.c(CH3COOH)c(H+)
B.c(CH3COO-)?c(H+)c(CH3COOH)
C.c(CH3COO-)c(CH3COOH)
D.c(CH3COO)c(CH3COOH)?c(OH-)
E.KW
(7)已知,H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ/mol。實驗測得稀醋酸與稀NaOH溶液反應生成1mol H2O時放出57kJ的熱,則醋酸溶液中,醋酸電離的熱化學方程式為。組卷:47引用:6難度:0.5 -
20.化學反應的調控對生活生產有著非常重要的意義,請回答下面題目:
Ⅰ進入秋冬,新冠肺炎疫情防控工作更需重視。戴醫用防護口罩是有效防控措施之一,醫用防護口罩的原料聚丙烯纖維單體為丙烯。
(1)丙烷氧化脫氫法可以制備丙烯,主要反應如下:C3H8(g)+O2(g)?C3H6(g)+H2O(g)△H<0。在催化劑作用下,C3H8氧化脫氫除生成C3H6外,還生成CO、CO2等物質C3H8的轉化率和C3H6的產率溫度變化關系如圖1:12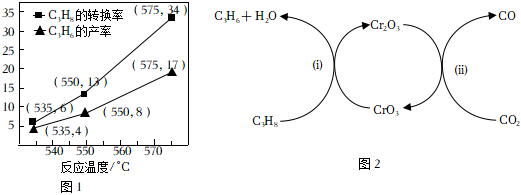
①550℃時,C3H6的選擇性為。(C3H6的選擇性×100%)C3H6的物質的量反應的C3H8的物質的量
②基于本研究結果,能提高C3H6選擇性的措施是。
③對于該反應,一定可以提高平衡體系中C3H6的百分含量,又能加快反應速率的措施是。
A.升高溫度
B.增加氧氣濃度
C.加入催化劑
D.降低壓強
(2)研究人員以鉻的氧化物為催化劑,利用CO2的弱氧化性,開發丙烷氧化脫氫制丙烯的新工藝。該工藝反應機理如上方圖2所示。
④該工藝總反應化學方程式為。
⑤該工藝可以有效消除催化劑表面的積炭,維持催化劑活性,原因是。
Ⅱ工業上可通過甲醇羰基化法制取甲酸甲酯,其反應的熱化學方程式為CH3OH(g)+CO(g)?HCOOCH3(g)△H=-29.1kJ?mol-1。科研人員對該反應進行了研究,部分研究結果如圖所示。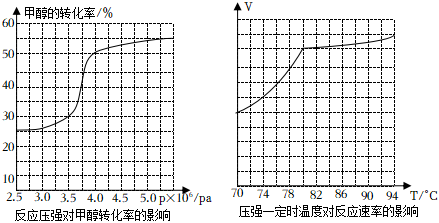
(3)從反應壓強對甲醇轉化率的影響“效率”看,工業制取甲酸甲酯應選擇的壓強是。(填“3.5×106 Pa”“4.0×106Pa”或“5.0×106Pa”)
(4)實際工業生產中采用的溫度是80℃,溫度不高于80℃的理由是。組卷:24引用:2難度:0.7


