2021-2022學年甘肅省武威市民勤四中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(下列各題只有一個選項符合題意。每小題3分,共60分)
-
1.以下現象與電化學腐蝕無關的是( )
A.黃銅(銅鋅合金)制作的銅鑼不易產生銅綠 B.銀質獎牌(純銀制成)久置后表面變暗 C.鐵質器件附有銅質配件,在接觸處易生鐵銹 D.生鐵比純鐵芯(幾乎是純鐵)容易生銹 組卷:35引用:5難度:0.9 -
2.X、Y、Z、W四塊金屬分別用導線兩兩相連浸入稀硫酸中組成原電池.X、Y相連時,X為負極;Z、W相連時,電流方向是W→Z;X、Z相連時,Z極上產生大量氣泡;W、Y相連時,W極發生氧化反應.據此判斷四種金屬的活動性順序是( )
A.X>Z>W>Y B.Z>X>Y>W C.X>Y>Z>W D.Y>W>Z>X 組卷:262引用:23難度:0.7 -
3.下列關于化學平衡常數K的敘述正確的是( )
A.K越大,反應物的轉化率越小 B.兩種物質反應,不管方程式怎樣書寫,平衡常數不變 C.溫度一定時,對于給定的化學反應,正、逆反應的平衡常數互為倒數 D.K與生成物的濃度有關 組卷:12引用:1難度:0.9 -
4.50mL濃度為2mol/L的鹽酸跟過量的鋅片反應,為加快反應速率,又不影響生成的氫氣的總量,可采用的方法是( )
A.加入適量的6mol/L的鹽酸 B.加入數滴氯化銅溶液 C.加入適量蒸餾水 D.加入適量的氯化鈉溶液 組卷:3引用:1難度:0.6 -
5.將鋁片和銅片用導線相連,一組插入濃HNO3溶液中,一組插入稀NaOH溶液中,分別形成了原電池,則在這兩個原電池中,正極分別為( )
A.鋁片、銅片 B.銅片、鋁片 C.鋁片、鋁片 D.銅片、銅片 組卷:38引用:10難度:0.7 -
6.如圖所示,各燒杯中盛有海水,鐵在其中被腐蝕由快到慢的順序為( )
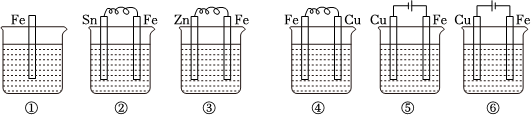
A.②①③④⑤⑥ B.⑤④③①②⑥ C.⑤④②①③⑥ D.⑤③②④①⑥ 組卷:134引用:28難度:0.5 -
 7.圖中x、y分別是直流電源的兩極,通電后發現a極板質量增加,b極板處有無色無臭氣體放出,符合這一情況的( )
7.圖中x、y分別是直流電源的兩極,通電后發現a極板質量增加,b極板處有無色無臭氣體放出,符合這一情況的( ) a電極 b電極 x電極 Z溶液 A 銅 石墨 負極 CuSO4 B 石墨 石墨 負極 NaOH C 銀 鐵 正極 AgNO3 D 銅 石墨 負極 CuCl2 A.A B.B C.C D.D 組卷:82引用:2難度:0.6
二、填空題(每空2分,共40分)
-
22.在容積為2L的密閉容器中進行如下反應:2A(g)+B(g)?nC(g)+2D(s),開始時A為2mol,B為2mol;2min末時測得剩余1.2molB,并測得C的濃度為1.2mol?L-1。
(1)前2min內C的平均反應速率為。
(2)前2min內B的平均反應速率為。
(3)化學方程式中n的值為。
(4)2min末時體系的壓強是反應前壓強的倍。
(5)下列各項可作為該反應達到平衡狀態的標志是。
A.壓強不再變化
B.氣體密度不再變化
C.A的消耗速率和B的消耗速率之比為2:1
D.A的濃度不再變化組卷:0引用:1難度:0.6 -
23.某研究性學習小組利用H2C2O4溶液和酸性KMnO4溶液之間的反應來探究“外界條件改變對化學反應速率的影響”,實驗如下:(不考慮溶液混合所引起的體積變化)
(1)通過實驗A、B,可探究出濃度的改變對反應速率的影響,其中V1=實驗
序號實驗
溫度
/K物質 溶液顏色褪至無
色時所需時間/sKMnO4溶液
(含硫酸)H2C2O4
溶液H2O V/mL c/mol?L-1 V/mL c/mol?L-1 V/mL A 293 2 0.02 4 0.1 0 6 B T 1 2 0.02 3 0.1 V 1 8 C 313 2 0.02 3 0.1 1 t 1 ,T1=;通過實驗(填實驗序號)可探究出溫度變化對化學反應速率的影響。
(2)C組實驗中溶液褪色時間t1(填“>”或“<”)8,C組實驗的反應速率v(KMnO4)=(用含t1的式子表示)。
(3)根據三個反應的時間的大小,可推測該實驗的結論是。
(4)寫出相應反應的離子方程式:。組卷:21引用:2難度:0.6


