2020-2021學年廣西桂林十八中高二(下)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共20小題,每小題只有一個選項符合題意,每小題2分)
-
1.合理利用燃料減小污染符合“綠色奧運”理念,下列關于燃料的說法正確的是( )
A.“可燃冰”是將水變?yōu)橛偷男滦腿剂?/label> B.氫氣是具有熱值高、無污染等優(yōu)點的燃料 C.乙醇是比汽油更環(huán)保、不可再生的燃料 D.石油和煤是工廠經常使用的可再生的化石燃料 組卷:194引用:21難度:0.9 -
2.下列敘述正確的是( )
A.水煤氣是二級能源 B.水力是二級能源 C.天然氣是二級能源 D.電能是一級能源 組卷:4引用:1難度:0.7 -
3.下列有關化學反應過程或實驗現(xiàn)象的敘述中,正確的是( )
A.氯氣的水溶液可以導電,說明氯氣是電解質 B.漂白粉和明礬都常用于自來水的處理,二者的作用原理是相同的 C.氯氣可以使?jié)駶櫟挠猩紬l褪色,但實際起漂白作用的物質是次氯酸而不是氯氣 D.氯氣、活性炭都能使品紅溶液褪色,它們的漂白原理相同 組卷:3引用:1難度:0.7 -
4.在N2+3H2?2NH3的反應中,經過一段時間,NH3的濃度增加了0.6mol/L,在此段時間內用H2表示的平均反應速率為0.45mol/(L?S),則所經過的時間是( )
A.1s B.2s C.0.44s D.1.33s 組卷:53引用:5難度:0.9 -
5.在密閉系統(tǒng)中有反應C(s)+CO2(g)?2CO(g),能使反應速率加快的措施是( )
①通過減小容器體積增大壓強
②升高溫度
③將炭粉碎
④通入CO2
⑤增加炭的量
⑥恒容條件下通入N2A.①②③⑥ B.①②④⑥ C.①②③④ D.①②③④⑤ 組卷:220引用:30難度:0.7 -
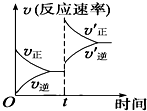 6.制取水煤氣的反應為C(s)+H2O(g)?CO(g)+H2(g)△H>0;在一定條件下達化學平衡后,在時間為t時突然改變條件,反應速率的變化如圖所示,在t時所改變的條件是( )
6.制取水煤氣的反應為C(s)+H2O(g)?CO(g)+H2(g)△H>0;在一定條件下達化學平衡后,在時間為t時突然改變條件,反應速率的變化如圖所示,在t時所改變的條件是( )A.加壓 B.升溫 C.增大水蒸氣濃度 D.增大碳的物質的量 組卷:104引用:14難度:0.7 -
7.在進行中和熱的測定中,下列操作或說法錯誤的是( )
A.不可將溫度計當攪拌棒使用,也不可靠在容器內壁上 B.攪拌時,環(huán)形玻璃攪拌棒應上下移動 C.測量反應混合液的溫度時要隨時讀取溫度,記錄下最高溫度 D.為了使反應完全,必須保證酸和堿恰好完全反應 組卷:56引用:6難度:0.9 -
8.心臟起搏器電源-鋰碘電池的電池反應為:2Li(s)+I2(s)=2LiI(s)△H
已知:4Li(s)+O2 (g)=2Li2O(s)△H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
則下列說法正確的是( )A.△H= △H1-△H212B.△H= △H1+△H212C.△H= △H1-12△H212D.△H= △H1+12△H212組卷:105引用:9難度:0.9
二、填空題(本題共4小題,共60分)
-
23.請應用化學反應原理的相關知識解決下列問題
(1)已知NaCl的溶解熱為3.8kJ?mol-1(吸熱)
Na(s)-e-═Na+(aq)ΔH=-240kJ/molCl2(g)+e-═Cl-(aq)ΔH=-167kJ/mol12
寫出鈉在氯氣中燃燒的熱化學方程式。
(2)一定條件下,在2L恒容密閉容器中充入1.5mol CO2和3mol H2發(fā)生反應:CO2(g)+3H2(g)?CH3OH(g)+H3O(g)
下圖是反應體系中CO2的平衡轉化率與溫度的關系曲線。已知在溫度為500K的條件下,該反應10min達到平衡;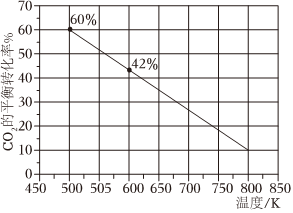
①該反應是(填“吸熱”或“放熱”)反應。
②在0~10min時段反應速率v(H2)為。
③若改充入2mol CO2和3mol H2,圖中的曲線會(填“上移”或“下移”)。
(3)根據(jù)下表數(shù)據(jù)回答問題:
表1 25℃時濃度為0.1mol/L兩種溶液的PH
表2 25℃,兩種酸的電離平衡常數(shù)如表。溶質 NaClO Na2CO3 PH 9.7 11.6
①根據(jù)表1能不能判斷出H2CO3與HClO酸性強弱?K1 K2 H2SO3 1.3×10-2 6.3×10-8 H2CO3 4.2×10-7 5.6×10-11 (填“能”或“不能”)。
②0.10mol?L-lNa2SO3溶液中離子濃度由大到小的順序為。
③H2SO3溶液和 NaHCO3溶液反應的離子方程式為。
(4)已知:t℃時,Ksp(AgCl)=1.5×10-10、Ksp (Ag2CrO4)=2.0×10-12;AgCl為白色沉淀,Ag2CrC4為磚紅色沉淀,t℃時,向Cl-和濃度均為0.1mol/L的混合溶液中逐滴加入AgNO3溶液至過量且不斷攪拌,實驗現(xiàn)象為CrO2-4。組卷:20引用:3難度:0.5 -
24.硫酸鉛,又名石灰漿,可用于鉛蓄電池、纖維增重劑、涂料分析試劑.工業(yè)上通常用自然界分布最廣的方鉛礦(主要成分為PbS)生產硫酸鉛.工藝流程如圖1:
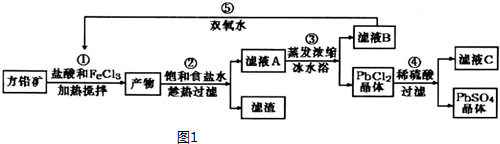
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2Cl-(aq)?PbCl42-(aq)ΔH>0
③Fe3+、Pb2+以氫氧化物形式開始沉淀時的pH值分別為1.9和7.
(1)流程中加入鹽酸可以控制溶液的pH<1.9,主要目的是.
反應過程中可觀察到淡黃色沉淀,則①對應的離子方程式為.
(2)②所得的濾液A蒸發(fā)濃縮后再用冰水浴的目的是(請用平衡移動原理解釋)
(3)④中對應反應的平衡常數(shù)表達式.
(4)上述流程中可循環(huán)利用的物質有.
(5)煉鉛和用鉛都會使水體因重金屬鉛的含量增大而造成嚴重污染.水溶液中鉛的存在形態(tài)主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形態(tài)的鉛濃度分數(shù)x與溶液pH變化的關系如圖2所示: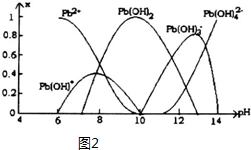
①探究Pb2+的性質:向含Pb2+的溶液中逐滴滴加NaOH,溶液變渾濁,繼續(xù)滴加NaOH溶液又變澄清;pH≥13時,溶液中發(fā)生的主要反應的離子方程式為..
②除去溶液中的Pb2+:科研小組用一種新型試劑可去除水中的痕量鉛和其他雜質離子,實驗結果記錄如下:
Ⅰ.由表可知該試劑去除Pb2+的效果最好,請結合表中有關數(shù)據(jù)說明去除Pb2+比Fe3+效果好的理由是離子 Pb2+ Ca2+ Fe3+ Mn2+ 處理前濃度/(mg?L-1) 0.100 29.8 0.12 0.087 處理后濃度/(mg?L-1) 0.004 22.6 0.04 0.053 .
Ⅱ.若新型試劑(DH)在脫鉛過程中主要發(fā)生的反應為:2DH(s)+Pb2+?D2Pb(s)+2H+,則脫鉛時最合適的pH約為.組卷:20引用:2難度:0.5


