2021-2022學(xué)年安徽省淮北師大附中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、單選題(本大題共16小題,共48.0分)
-
1.電池是人類生產(chǎn)和生活中的重要能量來源,各式各樣電池的發(fā)展是化學(xué)對人類的一大貢獻。下列有關(guān)電池的敘述正確的是( )
A.原電池反應(yīng)均是自發(fā)的氧化還原反應(yīng) B.氫氧燃料電池工作時氫氣在正極被氧化 C.氫氧燃料電池是將熱能轉(zhuǎn)化為電能的裝置 D.鉛蓄電池放電時,負極質(zhì)量減少,正極質(zhì)量增加 組卷:24引用:2難度:0.7 -
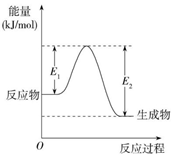
2.下列依據(jù)熱化學(xué)方程式得出的結(jié)論正確的是( )
A.在25℃、101 kPa時,2 gH2完全燃燒生成液態(tài)水,放出285.8kJ熱量,氫氣燃燒熱的熱化學(xué)方程式為:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ?mol-1 B.CO(g)的燃燒熱是283.0 kJ/mol,則2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ/mol C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1,若將含0.5 mol H2SO4的稀硫酸與1 mol NaOH固體混合,放出的熱量大于57.3 kJ D.已知C(石墨,s)?C(金剛石,s)△H=+1.9 kJ/mol,則金剛石比石墨穩(wěn)定 組卷:85引用:4難度:0.5 -
3.下列關(guān)于電解精煉銅與電鍍的說法正確的是( )
A.電解精煉銅時,將電能轉(zhuǎn)化為化學(xué)能,電路中每通過2mole-,陽極溶解64g銅 B.可從陽極泥中提取金、銀、鋅等金屬 C.在鐵制器皿上鍍鋁,熔融氧化鋁作電解質(zhì),鐵制器皿作陰極,鋁棒作陽極 D.電鍍過程中電鍍液需要不斷更換 組卷:182引用:4難度:0.8 -
 4.鉛蓄電池的 兩極分別為Pb、PbO2,電解質(zhì)溶液為H2SO4,作為原電池工作時的反應(yīng)為:Pb+PbO2+2H2SO42PbSO4+2H2O。下列結(jié)論或表述完全正確的是( )放電充電
4.鉛蓄電池的 兩極分別為Pb、PbO2,電解質(zhì)溶液為H2SO4,作為原電池工作時的反應(yīng)為:Pb+PbO2+2H2SO42PbSO4+2H2O。下列結(jié)論或表述完全正確的是( )放電充電A.Pb為負極被還原 B.SO42-向PbO2極移動 C.正極反應(yīng)為:PbO2+2H++SO42-+2e-=PbSO4+H2O D.若使用該電池并用碳棒電解CuSO4溶液,當(dāng)有1.6g純銅析出時,鉛蓄電池內(nèi)消耗硫酸物質(zhì)的量為0.05mol 組卷:15引用:2難度:0.7 -
5.下列說法中,不正確的是( )
A. 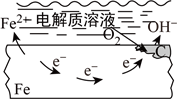
鋼鐵發(fā)生吸氧腐蝕B. 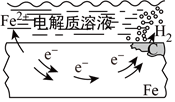
鋼鐵發(fā)生氫析腐蝕C. 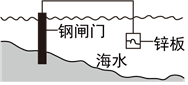
將鋅板換成銅板對照閘門保護效果更好D. 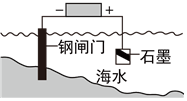
鋼閘門作為陰極而受到保護組卷:48引用:7難度:0.7 -
6.下列說法正確的是( )
A.熵增的反應(yīng)都是自發(fā)的,自發(fā)反應(yīng)的現(xiàn)象一定非常明顯 B.應(yīng)該投入大量資金研究2CO(g)→2C(s)+O2(g)△H>0該過程發(fā)生的條件,以解決含碳燃料不充分燃燒引起的環(huán)境問題 C.常溫下,若反應(yīng)A(s)+B(g)═C(g)+D(g)不能自發(fā)進行,則該反應(yīng)的△H>0 D.已知C(s)+CO2(g) 2CO(g)△H>0,該反應(yīng)是吸熱反應(yīng),一定不能自發(fā)進行高溫組卷:47引用:4難度:0.5
二、填空題(本大題共4小題,共52.0分)
-
19.電解原理在化學(xué)工業(yè)中有廣泛應(yīng)用.
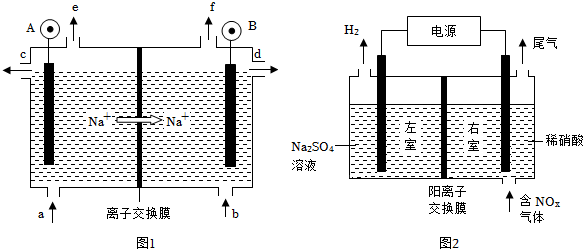
(1)電解食鹽水是氯堿工業(yè)的基礎(chǔ).目前比較先進的方法是陽離子交換膜法,電解示意圖如圖1所示,圖中的陽離子交換膜只允許陽離子通過,請回答以下問題:
①圖中A極要連接電源的(填“正”或“負”)極.
②精制飽和食鹽水從圖中位置補充,氫氧化鈉溶液從圖中位置流出.(選填“a”、“b”、“c”、“d”、“e”或“f”)
③電解總反應(yīng)的離子方程式是.
(2)電解法處理含氮氧化物廢氣,可回收硝酸,具有較高的環(huán)境效益和經(jīng)濟效益.實驗室模擬電解法吸收NOx的裝置如圖2所示(圖中電極均為石墨電極).若用NO2氣體進行模擬電解法吸收實驗.
①寫出電解時NO2發(fā)生反應(yīng)的電極反應(yīng).
②若有標準狀況下2.24L NO2被吸收,通過陽離子交換膜(只允許陽離子通過)的H+為mol.
(3)為了減緩鋼制品的腐蝕,可以在鋼制品的表面鍍鋁.電解液采用一種非水體系的室溫熔融鹽,由有機陽離子、A12Cl7-和AlCl4-組成.
①鋼制品應(yīng)接電源的極.
②已知電鍍過程中不產(chǎn)生其他離子且有機陽離子不參與電極反應(yīng),陰極電極反應(yīng)式為.
③若改用AlCl3水溶液作電解液,則陰極電極反應(yīng)式為.組卷:126引用:6難度:0.3 -
20.氮是地球上含量豐富的一種元素,氮及其化合物在工農(nóng)業(yè)生產(chǎn)、生活中有著重要作用,合成氨工業(yè)在國民生產(chǎn)中有重要意義。以下是關(guān)于合成氨的有關(guān)問題,請回答:
(1)若在一容積為2L的密閉容器中加入0.2mol的N2和0.6mol的H2在一定條件下發(fā)生反應(yīng):N2(g)+3H2(g)?2NH3(g)△H<0,若在5分鐘時反應(yīng)達到平衡,此時測得NH3的物質(zhì)的量為0.2mol。則前5分鐘的平均反應(yīng)速率v(N2)=。平衡時H2的轉(zhuǎn)化率為%。
(2)平衡后,若要提高H2的轉(zhuǎn)化率,可以采取的措施有。
A.加了催化劑
B.增大容器體積
C.降低反應(yīng)體系的溫度
D.加入一定量N2
(3)若在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下反應(yīng):N2(g)+3H2(g)?2NH3(g)△H<0,其化學(xué)平衡常數(shù)K與溫度T的關(guān)系如表所示:
請完成下列問題:①試比較K1、K2的大小,K1T/℃ 200 300 400 K K1 K2 0.5 K2(填“>”“<”或“=”);
②400℃時,反應(yīng)2NH3(g)?N2(g)+3H2(g)的化學(xué)平衡常數(shù)為。當(dāng)測得NH3、N2和H2物質(zhì)的量分別為3mol、2mol和1mol時,2NH3(g)?N2(g)+3H2(g)的v(N2)正v(N2)逆(填“>”“<”或“=”)。
(4)關(guān)于合成氨工藝的理解,下列說法不正確的是(填字母)。
A.合成氨工業(yè)常采用的反應(yīng)溫度為500℃左右,主要是為了節(jié)約能源
B.使用初始反應(yīng)速率更快的催化劑Ru,不能提高平衡時NH3的產(chǎn)率
C.合成氨工業(yè)采用的壓強為10MPa~30MPa,是因為常壓下N2和H2的轉(zhuǎn)化率不高組卷:21引用:2難度:0.5


