2022-2023學年遼寧省沈陽市東北育才學校高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個正確選項,每題3分,共20小題,60分)
-
1.隨著人們對物質組成和性質研究的深入,物質的分類更加多樣化。下列有關說法正確的是( )
A.磁性氧化鐵、鹽酸、漂白液都是混合物 B.Mn2O7、SO2、CO都是酸性氧化物 C.火堿、純堿、熟石灰都是強堿 D.HF、HClO、Fe(OH)2都是弱電解質 組卷:44引用:1難度:0.8 -
2.下列過程中,共價鍵被破壞的是( )
①石英熔化
②溴蒸氣被木炭吸附
③酒精溶于水
④HCl氣體溶于水
⑤碘升華
⑥NH4Cl受熱分解
⑦氫氧化鈉熔化
⑧Na2SO4溶于水A.②④⑥ B.④⑤⑥ C.①④⑧ D.①④⑥ 組卷:190引用:1難度:0.7 -
3.某元素的一種同位素X的原子質量數為A,含N個中子,它與1H原子組成HmX分子。在agHmX中所含質子的物質的量是( )
A. (A-N)molaA+mB. molaA(A-N)C. (A-N+m)molaA+mD. (A-N+m)molaA組卷:72引用:7難度:0.5 -
4.設NA表示阿伏加德羅常數的值。下列敘述正確的是( )
A.標準狀況下,2.24LD218O含有的中子數為1.2NA B.0.2mol?L-1BaCl2溶液中,Cl-的數目為0.4NA C.在常溫常壓下,1.6gN2H4含有的共用電子對數為0.25NA D.100mL12mol?L-1濃鹽酸與足量MnO2共熱,轉移電子數為0.6NA 組卷:53引用:1難度:0.6 -
5.化學與生產、生活和科學技術的發展有著密切的聯系,對社會發展、科技進步和人類生活質量的提高有著廣泛而深刻的影響。下列說法不正確的是( )
A.合金鋼也叫特種鋼,就是在碳素鋼里加入適量的一種或幾種合金元素 B.新型儲氫合金材料的研究和開發為氫氣能源的實際應用起到重要的推動作用 C.漂白粉既可作漂白棉、麻、紙張的漂白劑,又可用作游泳池等場所的消毒劑 D.碳酸鈉藥片和氫氧化鋁藥片可用于治療胃酸過多 組卷:52引用:1難度:0.7 -
6.短周期主族元素W、X、Y、Z的原子序數依次增大,X的原子半徑是所有短周期主族元素中最大的,W的核外電子數與X、Z的最外層電子數之和相等,Y的原子序數是Z的最外層電子數的2倍,由W、X、Y三種元素形成的化合物M的結構如圖所示。下列敘述正確的是( )
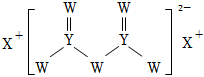
A.元素非金屬性強弱的順序為W>Y>Z B.Y單質的熔點高于X單質 C.W的簡單氫化物穩定性比Y的簡單氫化物穩定性低 D.化合物M中W不都滿足8電子穩定結構 組卷:124引用:5難度:0.5 -
7.下列離子方程式中正確的是( )
A.鐵與稀硫酸制氫氣:2Fe+6H+═2Fe3++3H2↑ B.硫酸氫鈉與氫氧化鋇混合使溶液呈中性:H++OH-═H2O C.碳酸氫鋇與過量的氫氧化鋇溶液反應:Ba2++HCO3-+OH-═BaCO3↓+H2O D.工業用氯氣制取漂白粉:Cl2+2OH-═Cl-+ClO-+H2O 組卷:39引用:1難度:0.7
二、第Ⅱ卷主觀題(共40分)
-
22.鈉及其化合物學習與探究:
Ⅰ.某課外活動小組設計了下列裝置,驗證Na2O2跟CO2反應時需要與水接觸。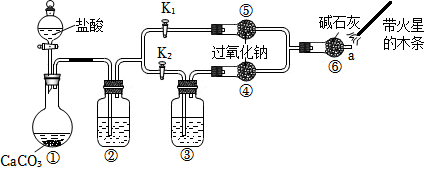
(1)①中反應的離子方程式是。
(2)裝置②中的試劑是(填序號),裝置③中的試劑是(填序號)。
a.飽和NaHCO3溶液
b.飽和Na2CO3溶液
c.濃H2SO4
(3)步驟1:打開彈簧夾K2,關閉K1,打開分液漏斗活塞加入鹽酸,將帶火星的木條放在a處。該步實驗的目的是:。
步驟2:打開彈簧夾K1,關閉K2,打開分液漏斗活塞加入鹽酸,將帶火星的木條放在a處。該步實驗的目的是:。
(4)實驗證明步驟1中a處帶火星的木條不復燃,步驟2中a處帶火星的木條復燃。活動小組從而得出了“Na2O2跟CO2反應時需要與水接觸”的結論。甲同學認為步驟2的O2可能只是水與Na2O2反應產生的,他設計了如下實驗證明裝置⑤中的確發生了Na2O2跟CO2的反應;實驗步驟和現象是:取裝置⑤中反應后的固體,滴加稀鹽酸,觀察到產生能使澄清石灰水變渾濁的氣體。乙同學覺得該設計也不合理,請你說明不合理的理由。
Ⅱ.取10g碳酸氫鈉樣品(含有不與鹽酸反應的雜質)放入燒杯中,稱得燒杯及所盛樣品的總質量為158g,再把100g稀鹽酸平均分成四份依次加入樣品中,每次均充分反應。實驗數據記錄如下(忽略氯化氫和水蒸氣的揮發):
(5)第一次加入稀鹽酸充分反應后,生成二氧化碳的質量是所加鹽酸的次數 第一次 第二次 第三次 第四次 鹽酸的質量/g 25 25 25 25 燒杯及所盛物質總質量/g 181.2 204.4 228.6 253.6 g。
(6)請你據此計算碳酸氫鈉的質量分數。組卷:64引用:2難度:0.9 -
23.次錳酸根離子(MnO43-),水溶液呈亮藍色,它在一些有機物的氧化過程中會以中間體出現,該離子不穩定,易發生歧化反應,工業上常用軟錳礦(主要成分MnO2,含有少量的SiO2、Fe2O3、Fe3O4、Al2O3以及其他少量不溶于水、不反應的雜質)為原料制備。現有一種制備流程如圖:
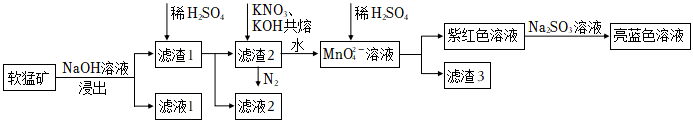
(1)濾渣1的主要成分是,Mn在周期表中的位置。
(2)流程中共熔時發生的主要反應的化學方程式為。
(3)寫出MnO42-轉變為紫紅色溶液的離子反應方程式。
(4)整個流程中的(填化學式)能重復利用。
(5)Al還原軟錳礦制備Mn的化學方程式為。
(6)往MnSO4溶液中加入過量NH4HCO3溶液可以制得MnCO3,該反應的離子方程式為。組卷:79引用:1難度:0.4


