2021-2022學年安徽省A10聯盟高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括14小題,每小題3分,共42分。每小題只有1個選項符合題意)
-
1.化學與生活息息相關,下列說法正確的是( )
A.食物儲藏在冰箱中,主要目的是便于食物的分類放置 B.為減少汽車尾氣污染,可在排氣管處設置催化轉化裝置 C.“冰,水為之,而寒于水”,說明冰的能量一定低于水 D.使用水煤氣的家庭灶具,可直接改用天然氣 組卷:4引用:1難度:0.7 -
2.下列關于反應熱大小比較正確的是( )
A.C(s)+ O2(g)═CO(g)ΔH112
C(s)+O2(g)═CO2(g)ΔH2 ΔH1>ΔH2B.S(l)+O2(g)═SO2(g)ΔH3
S(s)+O2(g)═SO2(g)ΔH4 ΔH3>ΔH4C.CH3COOH(aq)+OH-(aq)═H2O(l)+CH3COO-(aq)ΔH5
H+(aq)+OH-(aq)═H2O(l)ΔH6 ΔH5<ΔH6D.CaCO3(s)═CaO(s)+CO2(g)ΔH7
CaO(s)+CO2(g)═CaCO3(g)ΔH8 ΔH7<ΔH8組卷:88引用:4難度:0.5 -
3.已知N2(g)+3H2(g)?2NH3(g)ΔH=-akJ?mol-1。一定條件下,將1molN2和3molH2通入2L的恒容密閉容器,反應10min,測得H2的物質的量為2.4mol。下列說法正確的是( )
A.10min內,H2的平均反應速率為0.03mol-1?s-1 B.20min時,H2的物質的量濃度為0.9mol-1 C.10min內,N2的反應速率為0.01mol-1?min-1 D.達平衡時,N2和N2反應放出的熱量為akJ 組卷:0引用:1難度:0.4 -
4.下列選項中可表示該物質燃燒熱的熱化學方程式正確的是( )
A.CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=-890.3kJ?mol-1 B.2CO(g)+O2(g)═2CO2(g) ΔH=-466kJ?mol-1 C.NH3(g)+ O2(g)═NO(g)+54H2O(l)ΔH=-292kJ?mol-132D.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)ΔH=-1234.8kJ?mol-1 組卷:2引用:1難度:0.5 -
5.CaCO3/CaO相互轉化的能量關系如圖所示,下列說法不正確的是( )
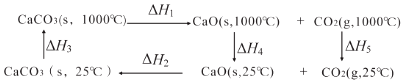
A.ΔH4<0 B.ΔH1+ΔH2=0 C.ΔH2+ΔH3+ΔH4+ΔH5<0 D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0 組卷:2引用:1難度:0.5 -
 6.一定條件下,CH4分解形成碳的反應歷程如圖所示,下列說法不正確的是( )
6.一定條件下,CH4分解形成碳的反應歷程如圖所示,下列說法不正確的是( )A.圖為是反應CH4═C+2H2的能量時間示意圖 B.第④步活化能量大 C.4個步驟中有的吸熱,有的放熱 D.選擇恰當催化劑可降低反應活化能 組卷:3引用:1難度:0.5
二、填空題(本題包括5個小題,共58分)
-
18.研究發現很熟悉的反應H2(g)+I2(g)═2HI(g)ΔH=-15kJ/mol,反應機理如下:
反應i I2(g)═2 I(g)ΔH1
反應ii H2(g)+2 I(g)═2HI(g)ΔH2
其能量與反應過程的關系如圖所示: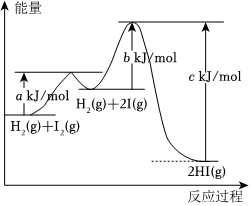
已知:對于基元反應aA+bB═cC+dD,其速率方程為v正=kca(A)cb(B)結合如圖回答下列問題:
(1)ΔH10(填“>”或“<”)。
(2)反應i逆反應的活化能為kJ/mol(用含a、b、c的代數式表示)。
(3)決定總反應速率快慢的是(填“反應i”或“反應ii”)。
(4)各步反應速率方程如下表,其中k1、k2、k3、k4分別為v1正、v1逆、v2正、v2逆的速率常數,且僅與溫度有關。
①上表中v2正=反應i 反應ii v1正=k1c(I2) v1逆=k2c2(I) v2正 v2逆=k4c2(HI) 。
②實驗測得總反應速率v=kc(I2)c(H2),則k=(用僅含k1、k2、k3的代數式表達)。
(5)將等物質的量的I2和H2置于預先抽真空的特制1L密閉容器中,加熱到1500K,起始總壓強為400kPa;平衡后,總壓強為450kPa。體系中存在如下反應關系:
I2(g)?2I(g) Kp1=100kPa
I2(g)+H2(g)?2HI(g) Kp2
1500K平衡體系中I(g)的分壓為kPa、Kp2=。組卷:23引用:2難度:0.6 -
19.某科學小組在973K下用CO還原過量的FeO,平衡時CO的體積分數為0.5951,相同溫度下H2還原過量FeO,平衡時H2的體積分數為0.7024。
請回答下列問題:
(1)根據上述實驗結果判斷,還原FeO(s)為Fe(s)的傾向是COH2(填“大于”或“小于”)。
(2)973K時,在密閉容器中將等物質的量的CO2和H2混合,發生反應CO2(g)+H2(g)=CO(g)+H2O(g),采用甲作催化劑進行反應,則平衡時體系中H2的轉化率50%(填“大于”、“等于”或“小于”)。
(3)已知1173K時,反應CO2(g)+H2(g)?CO(g)+H2O(g)、K=1.29,如圖3,在密閉容器沖入等物質的量的CO2和H2混合,分別使用催化劑甲、催化劑乙在不同溫度下反應一段時間測得H2的轉化率與溫度的關系,下列說法正確的是。
A.va(逆)>va(正)
B.a點平衡轉化率大于b點平衡轉化率
C.d點反應處于逆行進行中
D.e點后轉化率下降,可能是溫度升高催化劑失去活性
(4)以CO、H2和CO2制備甲醇
①CO2(g)+2H2(g)?CH3OH(g)
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
則ΔH1ΔH2(填“大于”、“等于”或“小于”)。已知CO可使反應的催化劑壽命下降,工業上用氫碳比表示反應物利用率,氫碳比=,則理論上氫碳比=[n(H2)-n(CO2)][n(CO)+n(CO2)]時,原料氣的利用率最高,但生產中往往采用略高于該值的氫碳比,理由是。
(5)CO和CO2也可相互轉化。向某體積可變的恒壓密閉容器(p)加入1molCO2與足量的碳,發生反應C(s)+CO2(g)?2CO(g),平衡時體系中氣體體積分數與溫度的關系如圖1所示。則925℃時壓強平衡常數K2是T℃壓強平衡常數K1的倍;在不同溫度下,平衡時體系中CO2體積分數與壓強的關系如圖2所示,則保持D點容器體積不變,降低溫度,達到新的平衡點可能是圖2中A-G中的點。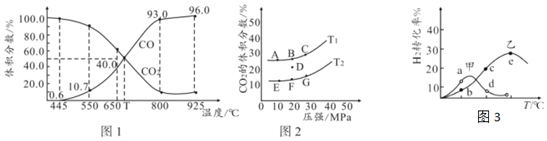 組卷:5引用:1難度:0.4
組卷:5引用:1難度:0.4


