2021-2022學年廣東省深圳高級中學高二(上)期中化學試卷
發布:2024/12/23 18:30:3
一、單選題(每小題只有一個選項符合題意,共10題,每題2分,共20分)
-
1.2021年9月24日,中國科學家在國際學術期刊《科學》中發表了以二氧化碳為原料,不依賴植物光合作用,直接人工合成淀粉的成果.核磁共振等檢測發現,人工合成淀粉分子與天然淀粉分子的結構組成一致.下列說法不正確的是( )
A.合成過程中需要氫原子的參與 B.可用碘染色來觀察淀粉的產生 C.人工合成的淀粉溶液無法產生丁達爾效應 D.該研究為糧食淀粉可持續供給、二氧化碳轉化利用提供新的戰略方向 組卷:20引用:2難度:0.6 -
2.室溫下,下列各組離子在指定溶液中能大量共存的是( )
A.酸性溶液:Na+、Mg2+、Cl-、HCO3- B.c(H+)=1×10-12的溶液:Na+、K+、ClO-、CO32- C.某無色透明的溶液:H+、Cu2+、SO42-、Cl- D.能溶解Al(OH)3的溶液:K+、NH4+、NO3-、CH3COO- 組卷:8引用:1難度:0.6 -
3.利用丙三醇催化氫解可制備丙二醇(沸點184.8℃),其原理
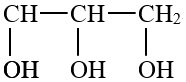 +H2催化劑
+H2催化劑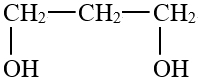 +H2O。已知NA是阿伏加德羅常數,下列說法正確的是( )
+H2O。已知NA是阿伏加德羅常數,下列說法正確的是( )A.0.5mol丙三醇中含有的羥基數為1.5NA B.1mol羥基中含有的電子數為10NA C.以上每消耗lg H2,生成水分子數為1NA D.標況下22.4L丙二醇中非極性共價鍵為2NA 組卷:4引用:1難度:0.8 -
4.下列關有機物的說法正確的是( )
A.CH3CH2COOH與CH3COOCH2CH3互為同分異構體 B.乙烯能使溴水和酸性高錳酸鉀溶液褪色,兩者褪色原理相同 C.石油裂化后的產物可用來做萃取實驗 D.乙酸與乙醇酯化反應后的產物可用飽和碳酸鈉溶液除雜 組卷:6引用:2難度:0.5 -
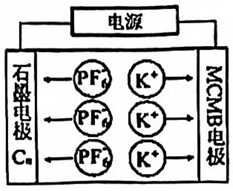 5.中科院研制出了雙碳雙離子電池,以石墨(Cn)和中間相炭微粒球(MCMB)為電極,電解質溶液爐含有KPF6的有機溶液,其充電示意圖如圖,下列說法錯誤的是( )
5.中科院研制出了雙碳雙離子電池,以石墨(Cn)和中間相炭微粒球(MCMB)為電極,電解質溶液爐含有KPF6的有機溶液,其充電示意圖如圖,下列說法錯誤的是( )A.放電時MCMB電極為負極 B.放電時K+往石墨電極方向移動 C.充電時,電子由電源負極出發通過有機溶液流向正極 D.充電時,陽極發生反應為Cn+xPF6-xe-═Cn(PF6)x 組卷:21引用:1難度:0.5 -
6.短周期主族元素W、X、Y、Z的原子序數依次增大,W的核外電子數等于其主族序數,X的單質在空氣中含量最多,Y的最高價氧化物的水化物是兩性化合物,Z的最高正價與最低負價代數和為4。下列說法錯誤的是( )
A.W與X形成的最簡單化合物電子式為 
B.Y和Z的簡單離子的電子層結構不同 C.Y和Z可形成化合物Y2Z3 D.最高正化合價Z>X>Y>W 組卷:37引用:1難度:0.5
三、填空題(共4題,共計56分)
-
19.氨基甲酸銨(H2NCOONH4)為尿素生產過程的中間產物,易分解.某小組對氨基甲酸銨的分解實驗進行探究.
已知:Ⅰ.N2(g)+3H2(g)?2NH3(g)ΔH1=-92.4kJ?mol-1
Ⅱ.C(s)+O2(g)?CO2(g)ΔH2=-393.8kJ?mol-1
Ⅲ.N2(g)+3H2(g)+C(s)+O2(g)?H2NCOONH4(s)ΔH3=-645.7kJ?mol-1
回答下列問題:
(1)寫出H2NCOONH4分解生成NH3與CO2氣體的熱化學方程式:.
(2)恒容條件下,實驗測得數據如下表所示:
①恒溫恒容時,下列能夠說明該反應已達到化學平衡狀態的是T/K 293 298 303 308 313 p/kPa 8.60 11.40 16.24 20.86 30.66 (填標號).
A.容器內總壓強不再改變
B.2v正(NH3)=v逆(CO2)
C.c2(NH3)c(CO2)的值不再改變
D.NH3的體積分數不再改變
②某溫度下,該反應平衡時容器內總壓強為p,寫出該反應的壓強平衡常數的計算式Kp=(用平衡分壓代替平衡濃度,分壓=總壓×物質的量分數).
③隨著溫度升高,Kp逐漸(填“增大”、“減小”或“不變”),其主要原因是.
④某溫度下,達到平衡后,欲增加NH3的平衡濃度,可采取的措施有(填標號).
A.加H2NCOONH4
B.加催化劑
C.減小體積增大壓強
D.移走CO2
(3)有人設想綜合利用太陽能將天然氣轉化為較易存運的甲醇,裝置如下圖,酸性工作環境時陽極反應的方程式為. 組卷:46引用:1難度:0.6
組卷:46引用:1難度:0.6 -
20.(1)已知亞磷酸(H3PO3)為二元弱酸,則Na2HPO3溶液中,各離子濃度的大小關系為
。
(2)常溫下,將NaOH溶液滴加到亞磷酸(H3PO3)溶液中,混合溶液的pH與離子濃度變化的關系如圖所示,則表示lg的是曲線c(HPO2-3)c(H2PO-3)(墳“Ⅰ”或“Ⅱ”),亞磷酸(H3PO3)的Ka1=。
(3)常溫時,0.1mol?L-1NH4Al(SO4)2溶液的pH=3.
①2c(SO42-)-c(NH4+)-3c(Al3+)≈mol?L-1.
②80℃時,0.1mol?L-1NH4Al(SO4)2溶液的pH小于3,請從平衡移動的角度分析導致pH隨溫度變化的原因是.
(4)常溫時,向100mL0.1mol?L-1NH4HSO4溶液中滴加0.1mol?L-1NaOH溶液,得到的溶液pH與NaOH溶液體積的關系曲線如圖所示。
①向NH4HSO4溶液中滴加NaOH溶液到a點的過程中,發生反應的離子方程式為.
②圖中a、b、c、d點中水的電離程度最小的是.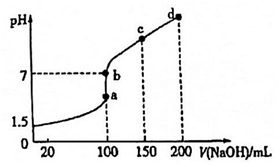 組卷:160引用:1難度:0.5
組卷:160引用:1難度:0.5


