2021-2022學年黑龍江省伊春市伊美二中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、單選題(共25小題,每小題2.0分,共50分)
-
1.下列過程中需要吸收熱量的是( )
①O2→2O ②2F→F2 ③SO3+H2O═H2SO4 ④2Na+2H2O═2NaOH+H2↑ ⑤KOH+CH3COOH═H2O+CH3COOK ⑥2NH4Cl+Ba(OH)2?8H2O═BaCl2+2NH3↑+10H2O⑦食物腐敗⑧液氨汽化A.①⑥⑧ B.①③⑥⑧ C.③④⑥⑦ D.①⑥⑦⑧ 組卷:19引用:5難度:0.7 -
2.下列說法正確的是( )
A.在稀溶液中,酸與堿發生中和反應生成1molH2O(l)時的反應熱叫做中和熱 B.測定中和熱時可用稀硫酸和稀Ba(OH)2溶液 C.測定中和熱實驗時,使用環形玻璃攪拌棒是為了加快反應速率,減小實驗誤差 D.在測定中和熱實驗中需要使用的儀器有:容量瓶、量筒、燒杯、溫度計、環形玻璃攪拌棒 組卷:22引用:2難度:0.7 -
3.已知:N2(g)+3H2(g)?2NH3(g)ΔH═-92.4kJ/mol。若斷裂1molH-H、1molN-H需要吸收的能量分別為436kJ、391kJ,則斷裂1molN≡N需要吸收的能量為( )
A.431kJ B.945.6kJ C.649kJ D.869kJ 組卷:158引用:25難度:0.5 -
4.把0.6molX氣體和0.4molY氣體混合于2L容器中,使它們發生如下反應:3X(g)+Y(g)=nZ(g)+2W(g)。5min末生成0.2molW,若測得以Z濃度變化來表示的化學反應速率為0.01mol/(L?min),則上述反應中Z氣體的化學計量數n的值是( )
A.1 B.2 C.3 D.4 組卷:415引用:6難度:0.7 -
5.下列事實不能用勒夏特列原理解釋的是( )
A.工業合成氨中,將氨氣液化分離以提高氨氣產率 B.盛有2mL5%H2O2溶液的試管中加入MnO2作催化劑,試管中迅速產生大量氣泡 C.SO2氧化為SO3,使用過量的空氣以提高SO2的利用率 D.夏天,打開啤酒瓶時會從瓶口逸出泡沫 組卷:17引用:4難度:0.7 -
6.合成氨工業N2(g)+3H2(g)?2NH3(g)在不同溫度下的平衡常數如下表:
下列關于該反應的說法錯誤的是( )溫度/℃ 25 400 平衡常數K a b A.實現了氮的固定 B.該反應放熱,a<b C.升溫,正、逆反應速率均增大 D.達到平衡后壓縮容器體積,N2轉化率增大 組卷:87引用:3難度:0.6 -
7.CO(g)+Cl2(g)?COCl2(g)△H<0,當反應達到平衡時,下列措施:①升溫、②加壓、③增加Cl2的濃度④加催化劑⑤恒壓通入惰性氣體⑥恒容通入惰性氣體。能提高CO轉化率的是( )
A.②③ B.③⑤ C.①④ D.③⑥ 組卷:85引用:6難度:0.9 -
8.將一定量純凈的氨基甲酸銨置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)。可以判斷該分解反應已經達到化學平衡的是( )
①2v(NH3)=v(CO2)
②密閉容器中總壓強不變
③密閉容器中混合氣體的密度不變
④密閉容器中氨氣的體積分數不變A.②③④ B.②③ C.①②③④ D.②④ 組卷:117引用:4難度:0.5 -
9.下列關于2SO2(g)+O2(g)?2SO3(g)△H=-197kJ?mol-1的說法正確的是( )
A.該反應的△S>0 B.該反應中,反應物的總能量小于生成物的總能量 C.生產過程中將SO3分離出去,逆反應速率減慢 D.其他條件不變,增大壓強,平衡右移,平衡常數增大 組卷:13引用:2難度:0.8
二、填空題(共4道題,每空2.0分,共50分)
-
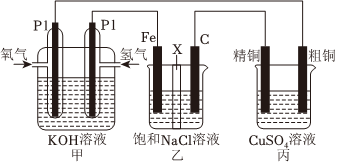 28.某同學設計一個燃料電池(如圖所示),目的是探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。根據要求回答相關問題:
28.某同學設計一個燃料電池(如圖所示),目的是探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。根據要求回答相關問題:
(1)石墨電極為(填“陽極”或“陰極”),反應一段時間后,在乙裝置中滴入酚酞溶液,(填“鐵極”或“石墨極”)區的溶液先變紅。乙池中電解總反應化學方程式為。
(2)如果粗銅中含有鋅、銀等雜質,丙裝置中反應一段時間,溶液中硫酸銅濃度將(填“增大”“減小”或“不變”)。精銅電極上的電極反應為。
(3)若在標準狀況下,有224mL氧氣參加反應,則乙裝置中鐵電極上生成的氣體在標準狀況下體積為mL;丙裝置中陰極析出銅的質量為g。
(4)若將甲改用Li2CO3和Na2CO3的熔融鹽混合物作電解質,CO為負極燃氣,空氣與CO2的混合氣為正極助燃氣,制得燃料電池,則該電池負極反應為,正極反應為。組卷:37引用:3難度:0.5 -
29.酸堿中和滴定是一種重要的實驗方法,用0.1000mol?L-1NaOH溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:
A.檢查滴定管是否漏水
B.用蒸餾水洗干凈滴定管
C.用待測定的溶液潤洗酸式滴定管
D.用酸式滴定管取稀鹽酸20.00mL,注入錐形瓶中,加入酚酞
E.取下堿式滴定管用標準的NaOH溶液潤洗后,將標準液注入堿式滴定管刻度“0”以上2~3cm處,再把堿式滴定管固定好,并排出尖嘴部分的氣泡,調節液面至刻度“0”或“0”刻度以下,
F.把錐形瓶放在滴定管下面,瓶下墊一張白紙,邊滴邊搖動錐形瓶直至滴定終點,記下滴定管液面所在刻度
G.另取錐形瓶,再重復操作2~3次
(1)排除堿式滴定管中氣泡的方法應采用如圖所示操作中的,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液。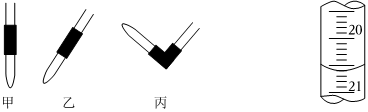
(2)判斷滴定終點的現象是:。
(3)如圖是第一次滴定時的滴定管中的液面,其讀數為X=mL。
(4)根據下列數據:請計算待測鹽酸溶液的濃度:mol/L。(保留四位有效數字).
(5)在上述實驗過程中,出現了以下錯誤操作(其他操作正確),其中會造成測定結果(待測液濃度值)偏高的有滴定次數 待測體積
(mL)標準燒堿體積(mL) 滴定前讀數 滴定后讀數 第一次 20.00 0.60 X 第二次 20.00 2.00 24.10 第三次 20.00 4.00 24.00 (雙選)。
A.量取標準液的堿式滴定管未潤洗
B.錐形瓶水洗后直接裝待測液
C.酸式滴定管水洗后未用待測稀鹽酸溶液潤洗
D.滴定到達終點時,俯視讀出滴定管讀數
E.堿式滴定管尖嘴部分有氣泡,滴定后消失
(6)有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10mL刻度處,現把管內液體全部流下排出,用量筒接收,得到溶液的體積是。
A.不能確定
B.為40mL
C.為10mL
D.大于40mL組卷:10引用:1難度:0.6


